高三理科补习班化学练习题
姓名 班级
相对原子量:H 1 He 4 C 12 N 14 O 16 Na23 S 32 Cu64 Ag 108 Sn119
第 Ⅰ卷
一、选择题(本题包括16小题,每题3分共48分。每小题只有一个选项符合题意。)
1.历史表明:没有新材料的出现,就没有科技和生产发展的突破。信息高速公路的建立在于寻找新的信息材料。下列材料可作信息材料的是
A.铜线 B.化纤 C.橡胶 D.光导纤维
2.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时血红蛋白被还原
3.已知KMnO4与双氧水反应的化学方程式为:
2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+K2SO4 +8H2O,则5molH2O2参加反应则转移电子
A.5mol B.20mol C.15mol D.10mol
4.简单原子的原子结构可用下图形象地表示:
![]()
其中![]() 表示质子或电子,
表示质子或电子,![]() 表示中子,则下列有关①②③的叙述正确的是
表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同位素 B.①②③为同素异形体
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
5.下列褪色过程不是因为氧化还原反应而褪色的是
A.SO2气体通入到溴水中使溴水褪色。
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红。
C.将SO2气体通入到滴有酚酞的NaOH溶液中,溶液褪色。
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去。-
6.碱性电池具有容量大、放电电流大的特点,因而得到广泛的应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A、电池工作时,锌为正极
B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e—=Mn2O3(s)+2OH—(aq)
C、电池工作时,电子有正极通过外电路流向负极
D、外电路中每通过0.2mol电子,锌的质量理论上减小13g
7.中科大陈乾旺教授等人发现合成金刚石的新方法,其化学原理为:
①Na+CO2 ![]() C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
以下有关表述中正确的是
A.反应①和②都存在旧化学键的断裂与新化学键的形成
B.新法利用的是化学变化,旧法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和②中,金刚石都是还原产物,Na2CO3是氧化产物
8.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:
c(Na+)>c(CH3COO-)>c(0H-)>c(H+),该溶液可能是
A.由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合而成
B.由1 mL0.1 mol·L-1的CH3COOH溶液与10 mL 1 mol·L-1的NaOH溶液混合而成
C.由0.1mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
D.由0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
9、下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4+8H+![]() Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
B.电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3—+2OH—![]() CaCO3↓+CO32—+2H2O
CaCO3↓+CO32—+2H2O
D.Na2S溶液呈碱性:S2—+2H2O![]() H2S+2OH—
H2S+2OH—
10、设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.常温常压下,48gO2和O3混合气含有的氧原子数为3NA
D.SiO2晶体中,1mol硅原子与氧原子共形成2NA个Si-O键
11、现有下列四个图像:
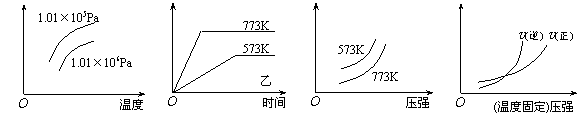 |
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) ![]() 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g) ![]() 2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) ![]() 4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.C(s)+CO2(g) ![]() 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
12、下列各组离子在水溶液中能够大量共存,无论向溶液中加入哪种物质,只要使由水电离产生的c(OH—)=1×10—14mo1·L—1,溶液中都会有沉淀生成。该组离子可能是
A.NH4+、K+、Cl—、SO32— B.K+、Na+、SiO32—、AlO2—
C.Ba2+、Na+、HSO3—、NO3— D.Fe2+、NH4+、NO3—、C1—
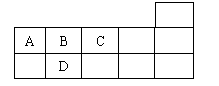 13、右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
13、右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
A.原子半径大小比较为D>B>C
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下可能均不导电
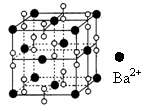 14、钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
14、钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
A.该晶体属于离子晶体 B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有8个
15、下列实验过程中产生的现象与对应的图形符合的是
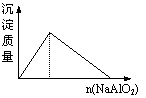 | |||
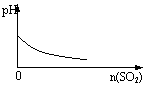 | |||
A.盐酸溶液中加入NaAlO2; B.SO2气体通入溴水中
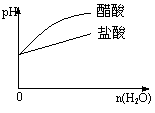 | |||
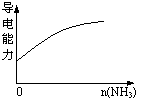 | |||
C.pH=2的醋酸与盐酸溶液分别加水稀释 D.氨气通入醋酸溶液中
16、0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-)>c(HS-)>c(OH-)>(H+)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=2c(S2-)+c(H2S)+c(HS-)+2(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
第Ⅱ卷
17.(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:___________;
(3)步聚2中,判断加入BaCl2已过量的方法是:______________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
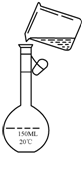 ________________________________________________;
________________________________________________;
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是________________________________________。
18.(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
19. (10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1) 硒的熔点范围可能是______________(2) 碲的化合价可能有_________________
(3) 硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是_________________(填化学式)。
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________。
 (5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
(5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3 + ( ) 一( )A1(OH)3↓ +( )H2Te↑
⑹已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式
_________________________________。
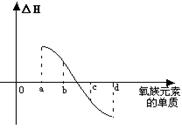
(7) 右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
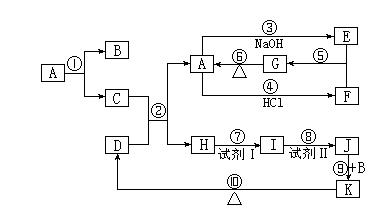 20.(11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
20.(11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
(1)写出下列物质的化学式:
A:___________; K:___________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的与离子方程式):
②:__________________________________________________________________:
③:__________________________________________________________________:
⑧:__________________________________________________________________:
⑨:__________________________________________________________________。
21.(12分)有如下化学反应:2A(g)+B(g)![]() 2C(g),△H<0。
2C(g),△H<0。
I (1)若将4molA和2molB在2L的容器中混合,经2s后达到平衡,测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若将amolA和bmolB、cmolC在2L的容器中混合,经2s后,达到平衡测得C的浓度为0.6mol·L-1,如果反应是从逆方向开始到达平衡,则c的取值范围_______________;
II若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
 III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
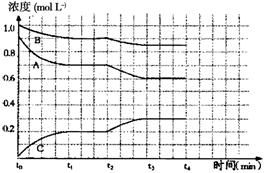
IV右图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是________________________________
高三理科补习班化学练习题
姓名 班级
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
化学试题参考答案及评分标准
一、单项选择题
1.D 2.B 3.D 4.A 5.C 6.B 7.A 8.C
9.B 10.C 11.B 12.B 13.B 14.A 15.B 16.A
三、(本题包括2小题,共22分)
17.(10分)(1)玻璃棒 漏斗 (2分)
(2)NaOH→BaCl2→Na2CO3 (2分)
(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量 (2分)
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 (2分)
(5)未用玻璃棒引流;未采用150 mL容量瓶。 (2分)
18.(12分)⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+ (每空1分)
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色
4Fe2++4H++O2=4Fe3++2H2O (每空2分)
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
19、(10分)⑴ 113 ~ 450℃ ⑵-2、+4、+6 ⑶H2Te>H2Se>H2S;
⑷ 还原性 (以上每空1分) 2H2Se + O2 == 2H2O + 2Se
⑸ A12Te3 + ( 6H2O) = 2A1(OH)3↓ +3H2Te↑ (以上每空1分)
⑹H2S(g)=H2(g)+S(s);△H=+112.2KJ/mol (2分)
⑺硒 氧气 (每空1分)
20.(1)Al2O3、Fe(OH)3(2)铝热剂(3)略
21.1 (1) 0.3mol·L-1·S-1 0.7mol·L-1(2)
2
![]() ×100% 、
×100% 、
3 85.7%(1分)减小 升高温度 充入A气体 减小压强
4 t1-t2 t3-t4降低温度