高三理科补习班化学练习题
班级___________ 姓名___________
可能用到的相对原子质量:H—1、C—12、N—14、O—16、S—32、Ca—40、Cu—64
第Ⅰ卷
选择题(每小题只有一个正确选项),
1.中国科学院在世界上首次发现铂元素的一种核素![]() ,下列有关叙述错误的是
,下列有关叙述错误的是
(A)铂元素原子的核外电子数为78 (B)铂元素的原子序数为202
(C)该原子核内有124个中子 (D)该原子的质量数为202
2.下列实验操作正确的是
A.从试剂瓶中取出的任何药品,若有剩余均不能再放回原试剂瓶
B.在中和滴定的实验过程中,目光应注视滴定管中的液面
C.用10mL量筒量取6.4mL稀盐酸
D.称取一定量NaOH固体放入量筒中加水溶解
3..在烧瓶中放入铜片和稀硝酸制取较纯净的一氧化氮,当烧瓶中出现红棕色气体后正确的操作是
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色气体消失后,用向上排空气法收集
C.待烧瓶中红棕色气体消失后,用排水法收集
D.立即用排水法收集
4.一定条件下,氨气与一氧化氮反应未配平的化学方程式为:NH3+NO——N2+H2O,
在反应中,被氧化与被还原的氮原子数之比为
(A)3∶2 (B)4∶5 (C)5∶6 (D)2∶3
5.下列分子中,所有原子都满足最外层为8电子结构的是
(A)BF3 (B)PCl5 (C)HCl (D)CF2Cl2
6.c(NH4+)相同的下列溶液:①氯化铵 ②硫酸铵 ③硫酸氢铵 ④碳酸氢铵,其物质的量浓度由大到小的顺序是
A.②③①④ B.②④①③ C.①④③② D.④①③②
7.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
(A)H3O+、![]() 、Fe2+、Na+ (B)Ag+、
、Fe2+、Na+ (B)Ag+、![]() 、Cl-、K+
、Cl-、K+
(C)K+、Ba2+、OH-、![]() (D)Cu2+、
(D)Cu2+、![]() 、Br-、OH-
、Br-、OH-
8. 在25℃101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程
式分别为:P4(s)+5O2(g)= P4O10(s);△H = -3093.2 kJ/mol
4P(s)+5O2(g)= P4O10(s);△H = -2954.0 kJ/mol
由此判断,下列说法正确的是
(A)由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
(B)由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
(C)由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
(D)由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
9.下列反应的离子方程式正确的是
(A)硫酸铜溶液与氢氧化钡溶液反应: Ba2++![]() = BaSO4↓
= BaSO4↓
(B)向三氯化铝溶液中加入过量氨水:Al3++3NH3·H2O = A1(OH)3↓+![]()
(C)向碳酸氢钙溶液中加入过量氢氧化钠溶液:
Ca2++![]() +OH— = CaCO3↓+H2O
+OH— = CaCO3↓+H2O
(D)石灰石溶于醋酸: CaCO3+2H+= Ca2++CO2↑+H2O
10.将0.1 mol/L的醋酸溶液加水稀释,下列说法正确的是
(A)溶液中c(H+)和c(OH—)都减小 (B)溶液中c(H+)增大
(C)醋酸电离平衡向左移动 (D)溶液的pH增大
11. NA为阿伏加德罗常数,下列说法中正确的是
(A)标准状况下11.2 L O3 中含NA个氧原子
(B)1 mol![]() 离子中,含有的电子数为11NA
离子中,含有的电子数为11NA
(C)1 mol C12H26分子中,共价键总数为37NA
(D)100 mL 0.1 mol/L AlCl3溶液中,Al3+个数为0.01NA
12.下列事实不能用勒夏特列原理解释的是
(A)工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
(B)合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
(C)实验室用排饱和食盐水的方法收集氯气
(D)经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
13. 最新研制的一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池。下列有关此电池的叙述错误的是
(A)正极电极反应:O2+2H2O+4e—= 4OH—
(B)负极电极反应:CH3OH+8OH—-6e—=![]() +6H2O
+6H2O
(C)电池在使用过程中电解质溶液的pH升高
(D)当外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g
 14.最近发现一种由M、N两种原子构成的气态团簇分子,如图所示。
14.最近发现一种由M、N两种原子构成的气态团簇分子,如图所示。
实心球●表示N原子,空心球○表示M原子,它的化学式为
A.M4N4 B.MN C.M14N13 D.M4N5
15. 常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是
(A)当pH>7时,c(Cl—)>c(![]() )>c(OH—) >c(H+)
)>c(OH—) >c(H+)
(B)当pH=7时,c(![]() )>c(Cl—)>c(H+)=c(OH—)
)>c(Cl—)>c(H+)=c(OH—)
(C)当pH<7时,c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
(D)当氨水与盐酸恰好完全反应时,c(Cl—)>c(![]() )>c(H+)>c(OH—)
)>c(H+)>c(OH—)
16. 常温下Ca(OH)2溶于水达饱和时存在如下平衡:Ca(OH)2(s)![]() Ca(OH)2(aq),Ca(OH)2 = Ca2++2OH—。饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
Ca(OH)2(aq),Ca(OH)2 = Ca2++2OH—。饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
(A)![]() g
(B)
g
(B)![]() g
g
(C)![]() g
(D)
g
(D)![]() g
g
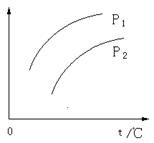 17.在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
17.在容积一定的密闭容器中发生可逆反应A(g)+2B(g)![]() 2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是
(A)P1< P2,纵坐标指A的质量分数
(B)P1> P2,纵坐标指C的质量分数
|
|
18.A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是
①n+2 ②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是
(A)①④ (B)②⑧ (C)③⑤ (D)⑥⑦
第Ⅱ卷
19.(6分)
(1)在中和热的测定实验中,取50 mL 0.50 mol /L的盐酸,需加入下列 试剂(填序号)。①50 mL0.50 mol/L NaOH溶液 ②50 mL0.55 mol/L NaOH溶液
③1.0 g NaOH固体
 (2)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
(2)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
20.(10分)
已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+已完全水解,转化为Fe(OH)3。某同学欲提纯含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液,并利用电解纯净的CuSO4溶液得到的数据,计算Cu的相对原子质量。
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。
A的化学式为___________,加入A的作用是__________
_________________________________________________;
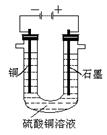
(2)将较纯净的CuSO4溶液放入右图所示的装置中进行电解,
石墨电极上的电极反应式为_________________________________________, 电解反应的离子方程式为___________________________________________;
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重a g,则Cu
的相对原子质量(用带有a、V的计算式表示)为_______________________。
21.(12分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液 ④Na+无水乙醇。为点燃上述四个反应生成的H2,他们设计了如下装置图:
![]() 请回答下列问题:
请回答下列问题:
⑴写出Na与H2O反应的化学方程式 ;
⑵在点燃H2之前必须先进行 ,方法是
;
⑶实验小组在点燃用上述装置制得的H2时,①③④实验获得成功,②却
失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的
用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危
险的原因是 。
⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
![]()
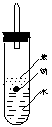
原实验 改进后实验
在改进后的实验中H2的生成速率减慢。原因是
。
22.(8分)现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为_______________________;
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为_____________;
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为
__________________________________________________________________;
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为
__________________________________________________________________。
23.(8分)(1)光导纤维是一种能高质量传导光的玻璃纤维,利用光缆通讯,能同时传输大量信息。制造光纤电缆的主要原材料的化学式是 ,它属于 材料。
(2)有些烟幕弹产生烟幕的原理是应用了水解反应。水解反应是一类广泛存在的反应,如PCl3、SiCl4易水解,PCl3的水解反应为PCl3+4H2O H3PO4+5HCl。现代海战中,常常通过喷放SiCl4和液氨产生大量烟幕,所涉及反应的化学方程式是
。
24.(12分)气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。常温下B、D、E是常见气体,C是液体。各物质有如下图所示的转化关系。
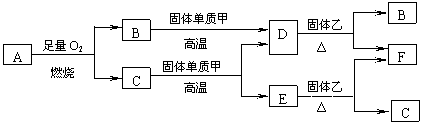 |
试回答下列问题:
⑴若气体A是纯净物,且A分子的空间构型为直线型,则A的电子式为 ;
⑵若气体A是混合气体,且X与Y的质量比小于3,则气体A中肯定有(写化学式)
;
⑶若D与固体乙反应过程中有明显的颜色变化,则乙可能为 (写化学式);
⑷C与固体甲在高温下反应的化学方程式为 ;
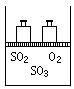 25.(8分)如图,将4 mol SO2和2 mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)
25.(8分)如图,将4 mol SO2和2 mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
(1)在该平衡状态时n(SO3)=______________________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为____________________________;
(3)若反应开始时的U (逆)> U (正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。则起始时n(SO3)的取值范围是________________________________。
高三理科补习班化学练习题
一、选择题
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答 案 | B | C | C | D | D | D | A | D | B |
| 题 号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答 案 | D | C | D | C | C | D | A | B | C |
二、(本题包括2小题,共16分)
19.(1)②(2分)
(2)![]() ×100% (2分)(说明:答
×100% (2分)(说明:答![]() 得分) 偏高(2分)
得分) 偏高(2分)
20.(1)CuO (2分) 调节溶液pH至4~5,除去Fe3+(2分)(答降低溶液酸度,除去Fe3+可得分)
(2)4OH--4e- = O2↑+2H2O (2分)
2Cu2++2H2O2Cu+O2↑+4H+(2分)(不配平、条件错误不得分)
(3)![]() (2分)
(2分)
21、⑴2Na+2H2O=2NaOH+H2↑
⑵验纯,用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。
⑶较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。
⑷钠比水轻,比苯重,落在苯水交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速度。
22.(1)S、Al(2分)(说明:写对1个得1分)
(2)Na、Al、S、O(2分)
(3)2Na2O2 +2CO2 = 2Na2CO3 + O2(2分)
(4)3S
+ 6OH- = 2S2- + ![]() + 3H2O(2分)
+ 3H2O(2分)
23.⑴SiO2 ⑵无机非金属材料
(2)SiCl4+2H2O=SiO2+4HCl或SiCl4+3H2O=H2SiO3+4HCl;NH3+HCl=NH4Cl
24、⑴![]() ⑵H2 ⑶Fe2O3若CuO ⑷C+H2O
⑵H2 ⑶Fe2O3若CuO ⑷C+H2O CO+H2
CO+H2
25.(1)3.6 mol (2分)
(2)≥0 (3分)(说明:答“任意值”可得分)
(3)3.6 mol< n (SO3)≤4 mol(3分)