可能用到的相对原子质量:H:1 N:14 Fe:56 Cu:64
6、韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的是( )
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
7、下列反应中,氧化产物是有色单质的是( )
A.2NO+O2=2NO2 B.CuCl2+Zn=Cu+ZnCl2
C.2KI+Br2=2KBr+I2 D.C+2CuO![]() 2Cu+CO2
2Cu+CO2
8、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16
B.13C和15N原子核内的质子数相差2
C.1H216O在相同条件下比1H218O更易蒸发
D.2H+的酸性比1H+的酸性更强
9、阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是( )
A.同温、同压下,相同体积的氟气和氩气所含的原子数相等
B.1mol C3H8分子中共价键总数约为10×6.02×1023
C.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数约为0.2×6.02×1023
D.1mol 甲基所含电子数约为8×6.02×1023
10、莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是( )
A.c(SO![]() )>
c(NH
)>
c(NH![]() )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(NH3·H2O)+c(NH![]() )=
0.2mol/L
)=
0.2mol/L
C.2 c(SO![]() )+
c(OH-)= c(NH
)+
c(OH-)= c(NH![]() )+2
c(Fe2+)+c(H+)
)+2
c(Fe2+)+c(H+)
D.c(H+)= c(OH-)+c(NH3·H2O)
11、下列各对应反应的离子方程式正确的是 ( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
B.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-=Cl2↑+Mn2++H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.用可溶性铝盐溶液和过量氢氧化钠溶液制取氢氧化铝:Al3++3OH-=Al(OH)3
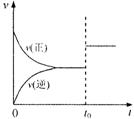 12、可逆反应aX(g)+bY(g)
12、可逆反应aX(g)+bY(g)![]() cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
13、已知t℃时,盐M(不含结晶水,摩尔质量为126g·mol-1)的溶解度为S g。在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液,饱和溶液的密度是ρg·mL-1,物质的量浓度是c mol·L-1,质量分数为ω。若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入b g M·7H2O,下列等式不正确的是( )
A.b(100-s)=200a
B.a=b/2
C.126c(100+s)=1000sρ
D.1000ωρ=126c
26、Ⅰ:(4分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
(1)该反应中还原剂是_____________;该反应中还原产物是_______________;
(2)若反应过程中转移了0.3mol电子,则生成水的质量是___________________Ⅱ:(8分)某温度,水的离子积常数KW=10-13,将此温度下PH=11的Ba(OH)2 溶液aL与PH=1的H2SO4溶液bL混合。(设混合溶液体积为两者之和,固体体积忽略不计)
(1)若所得混合溶液为中性,则a∶b= ,生成沉淀的物质的量为 mol.
(2)若a∶b=9∶2,则所得溶液PH= ,该混合溶液最多能够溶解铁粉
g。(最终结果用含的表达式来表示)
27、(23分)Ⅰ:(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入____ ______(填A或B)________mol(用a表示)。
Ⅱ:(13分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ
(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。
肼—空气燃料电池放电时:
|
负极的电极反应式 。
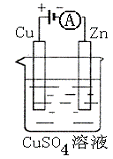
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标准状况下的空气 L
(假设空气中氧气体积含量为20%)
28、(14分)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的核外电子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子
式分别为__________________、___________________、___________________
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化
物的水化物的浓溶液加热时反应的离子方程式__________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是_________.
29、(11分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
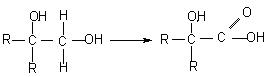
为了合成该物,某实验室的科技人员设计了下列合成路线:
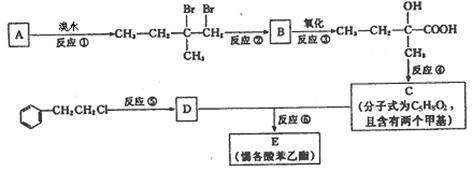
试回答下列问题:
(1) 试写出:A的结构简式_______________;B的结构简式________________。
(2) 反应②中另加的试剂是_______________;反应④的一般条件是______________。
(3) 试写出反应生成E的化学方程式:____________________________________________。
(4) 上述合成路线中属于取代反应的是 (填编号)。
 高三理综化学科第四次月考试卷
高三理综化学科第四次月考试卷
答案卷
一、选择题(每小题只有一个正确答案)
| 题 号 | 6 | 7 | 8 | 9 |
| 答 案 | ||||
| 题 号 | 10 | 11 | 12 | 13 |
| 答 案 |
二、填空题
26、Ⅰ:(1) (2)
Ⅱ:(1)a∶b= mol.
(2)PH= , g
27、Ⅰ: (1)x=__________。 (2)α(A):α(B)= ;
(3) _________ (4) ____ ___ ,________ mol(用a表示)。
Ⅱ:(1)
(2)正极的电极反应式是 。
负极的电极反应式 。
(3)① 。② L
28、(1)X_________Z__________
(2)________________,__________________、___________________
(3) ___________, __________
(4) _________.
29、(1) _______________; _______________。
(2) _______________; ______________。
(3) ____________________________________________。
(4) (填编号)。