高三理综化学第二学期统一练习二
5.下列物质分离过程中涉及共价键断裂的是
A.用渗析法除去淀粉胶体中的少量NaCl
B.用饱和食盐水洗去Cl2中的少量HCl
C.用CCl4萃取碘水中的碘
D.用升华法除去NaCl中混有的少量碘
6. 如右图所示的两个实验装置中,溶液的体积均
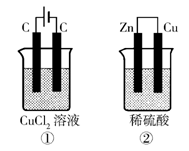
为200mL,开始时电解质溶液的浓度均为0.1mol/L,
工作一段时间后,测得导线中均通过0.02mol电子,
若不考虑盐的水解和溶液体积的变化,则下列叙述
中正确的是
A.产生气体的体积:①>②
B.溶液的pH变化:①增大,②不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e- Cl2 ↑
②中负极 2H++2e- H2↑
7. 根据相关化学原理,判断下列正确的是 A.若X的质子数为a,中子数为b,则X的质量数为:a - b
B.若A2+2D- 2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
8.下列叙述正确的是
A.1mol甲基(-CH3)中含有电子的个数为7×6.02×1023
B. 1mol Na2O2固体中含有O22-离子的个数为2×6.02×1023
C.1L 0.5mol·L-1的(NH4)2SO4溶液中含有NH4+离子的个数为6.02×1023
D.常温常压下,相同质量的乙烯与丙烯中含有的共用电子对数目相同
9. 关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加盐酸沉淀不消失,则原溶液中有Cl-存在
B.加入Ba(NO3)3溶液,生成白色沉淀,加盐酸沉淀不消失,则原溶液中有SO42-存在
C.先通入Cl2,溶液变成黄棕色,再滴入淀粉试液后,溶液又变蓝,则原溶液中有
I-存在
D.加入盐酸,生成了能使澄清石灰水变浑浊的气体,则原溶液中有CO32-存在
10.按照下图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝, c处得到液体,则X气体可能是(假设每个反应均完全)
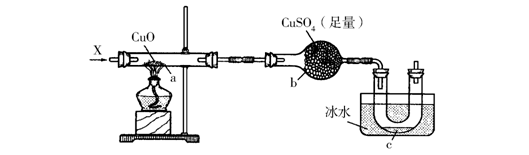
A.CH3CH2OH B.CO 或 H2
C.NH3 D.H2
11.相同温度下,下列实验过程中,溶液的浓度和质量始终不变的是
A.向98.3%浓H2SO4中加入n g SO3
B.向浓氨水中持续通入干燥洁净的空气(已除去CO2)
C.向KNO3饱和溶液中加入n g KNO3晶体
D.向CuSO4饱和溶液中加入n g无水CuSO4
12.将14g铁粉投入到500 mL某稀硝酸中,经充分反应后,测得Fe和HNO3均无剩余。已知反应放出的气体在标准状况下为4.48L。假定反应前后溶液的体积不变且还原产物只有一种,则原硝酸的物质的量浓度是
A.0.8mol/L B.1.6mol/L C.1.4 mol/L D.0.75mol/L
II卷化学:![]()
25.(17分)已知反应:(1)
![]()
(2) ![]()
现有物质A~I的转化关系如下图:
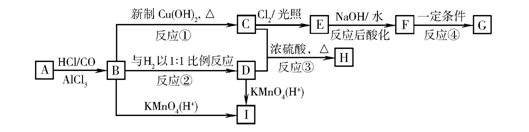 B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题:
B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题:
(1)反应②的反应类型是 反应。
(2)写出有关物质的结构简式:F ,I 。
(3)写出下列反应的化学方程式:
B→C ;
C+D→H 。
(4)C的同分异构体且属于酯类的芳香族化合物共有6种,以下已有四种,请写出另两种同分异构体的结构简式:
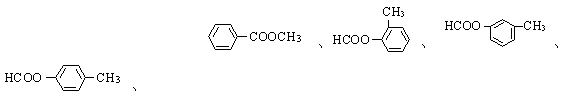
、 。
26。(16分)26。(16分)已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,反应②为D的浓溶液与C在加热条件下的反应。P溶液和G溶液中具有相同的阳离子。请根据要求回答下列问题:
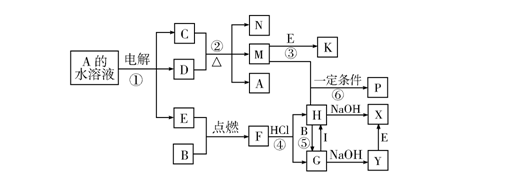
(1)写出I的化学式 。
(2)写出反应①中阴极发生的电极反应式
.
写出反应①的化学方程式
.
(3)写出反应④的离子方程式
.
写出反应⑤的离子方程式
.
写出反应⑥的离子方程式
.
(4)每生成1 mol K,反应放出98。3,kJ 热量,该反应的热化学方程式为
__________________________________________________________________________.
27.(18分)某校化学研究性学习小组要利用已经学过的化学知识制取少量漂白粉,并进一步探究漂白粉的化学性质。他们查阅资料得知:2Cl2+2Ca(OH)2=Ca(ClO) 2+CaCl2+2H2O该反应属于放热反应,温度稍高时便发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。学生设计出了甲、乙、丙三套装置:
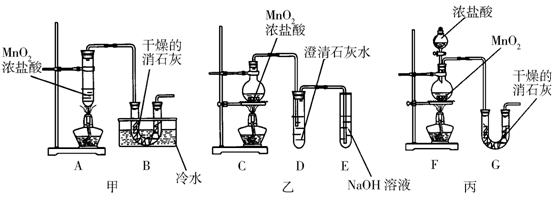
请从甲、乙、丙各套装置中选取合理的部分,按气体从左至右的流向组装成一套比较合理的装置(填各部分仪器的字母编号) 。
⑵部分学生认为上述组装仍存在缺点,他们指出在前两个仪器之间应增加如下装置:
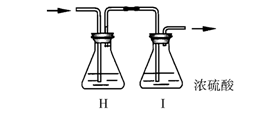
你认为H洗气瓶中所盛液体是 ,其作用是 ,
若无此装置,对制漂白粉有什么不利影响 。
洗气瓶I有无必要 ,理由是
。
⑶为了研究所制得的漂白粉的化学性质,同学们把少量漂白粉投入到淡绿色的FeCl2溶液,所产生的现象是 。由此可知漂白粉溶液所具有化学性质是 。
28.(9分)A、B、C、D是原子序数由小到大的四种短周期元素。已知C和D可形成化合物X,A和B可形成化合物Y,将少量X和过量Y一起放入水中,可放出一种无色无嗅的气体单质,同时得到一种无色澄清的溶液。向此溶液中滴加过量X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对分子质量相等),过滤后得到一种无色澄清溶液,其中含G,G在焰色反应中火焰呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀物,根据以上推断,请完成下列填空:
(1)X的化学式是________________,Y的化学式是_________________________.
(2) 4 mol X与6 mol Y在水溶液中发生反应的化学方程式为
_______________________________________________________________________
(3)生成白色胶状沉淀物Z的离子方程式为
_________________________________________________________________________
化学参考答案:I卷
| 题号 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | C | D | D | C | A | C | B |
II卷25.(17分)
(1)加成 (还原) (3分)
![]() (2) (4分)
(2) (4分)
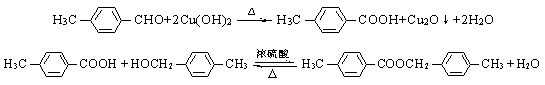 (3)
(3)
(6分)
(4)
(4分)
26.(16分)
(1)Cl2 (2分)
(2)Cu2++2e-=Cu 2CuSO4 +2 H2O 2Cu+O2↑+2H2SO4 (4分)
(3)Fe3O4+8H+=2Fe3++Fe2++4H2O (2分)
Fe +2Fe3+=3Fe2+ (2分)
2 Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (3分)
(4)SO2(g) +![]() O2(g ) =SO3 (g) ,△H=-98.3kJ/
mol (3分)
O2(g ) =SO3 (g) ,△H=-98.3kJ/
mol (3分)
27.(18分)
⑴ F B E (3分)
⑵ 饱和食盐水 除去Cl2中的HCl HCl会与Ca(OH)2及Ca(ClO)2反应
无必要 (每空2分共8分)
因为工业生产漂白粉是通过氯气与石灰乳作用制成的, Cl2与Ca(OH)2反应需要少量水参与 ,所以氯气不需要干燥 (3分)
⑶ 生成红褐色沉淀 氧化性和碱性 (每空2分共4分)
28.(9分)(1)AlCl3 Na2O2 (每空2分共4分) (2) 4AlCl3 +6Na2O2+6H2O =4Al(OH)3↓+12NaCl+O2↑ (3分)
(3) Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分)