高三理综化学第四次预测模拟考试试卷
预测试题
6.科学家正在研究开发新的能源,如核能、太阳能、风能、地热、潮汐热等。“绿色能源”是目前正在研究的新能源之一,把高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种。这种“绿色能源”的物质是
A.氢气 B.甲烷 C.酒精 D.木炭
7.下列说法中,正确的一项是
A.用乙醇或CC14 可提取碘水中的碘单质
B.NaCl 和SiC 晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S 晶体中电子总数与中子总数之比为1 : 1
D.H2S和SiF4分子中各原子最外层都满足8 电子结
8.下列物质中,既可以跟盐酸发生反应,又可以跟氢氧化钠溶液发生反应的一组是
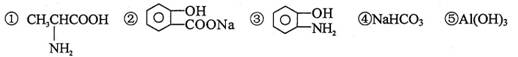
A.①④⑤ B.①②④⑤ C.②③⑤ D.①②③④⑤
9.下列实验报告记录的实验现象正确的是
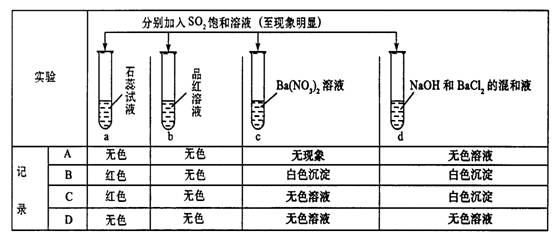 |
10.含碳 4.8 %的某生铁样品中,加入 1.4mol/L 的稀硝酸 500ml,完全反应后生成标准状况下的 NO 气体 3 . 36L ,要使溶液中的铁元素完全沉淀,需加入2mol / L NaOH 溶液的体积为
A.275mL B.350mL C.560mL D.700 mL
11.常温下,浓度都是1 mol·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(x-)=1 mol·L-1,BX的溶液pH=4,BY的溶液pH=6。则AY的溶液pH为
A.大于7 B.等于7 C.小于7 D.无法判断
12.下列表示变化的用语中正确的一项是
A.NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.1 L 0.5mol·L-1稀硫酸与I L lmol· L-1氢氧化钠溶液反应放出57.3kJ 热量:
H2SO4(aq ) +2NaOH ( aq ) = Na2SO 4(aq ) + 2H2O ( l ) ;△h=一57.3kJ · mol -1
C.氢氧燃料电池的负极反应式为:O2 +
2H2o + 2e 一=4OH-
D.以惰性电极电解KCl 溶液:2Cl一十2H2O![]() H2↑ + Cl2↑+2OH-
H2↑ + Cl2↑+2OH-
13.T℃时,A 气体与B 气体反应生成C 气体,反应过程中A 、B 、C 浓度变化如图(I)所示,若保持其他条件不变,温度分别为T2和T2时,B 的体积分数与时间关系如图(II)所示,则下列结论中正确的一项是
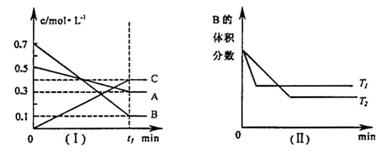
A.在tl 时间内用B 表示该反应的平均速率为:0.6mol · L-1·min-1
B.在(t1 + 10 )min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol/LA、0.lmol/LB 和0.4mol/LC达到平衡后,C 的浓度仍为0 .4mol/L
D.其他条件不变,升高温度,正、逆反应速率均增大,且A 的转化率增大
26.Ⅰ(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: 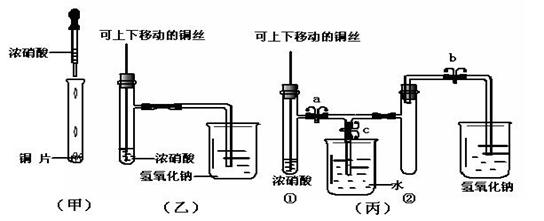
(1)甲、乙、丙三个装置中共同发生的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何
操作 。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
Ⅱ、(9 分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
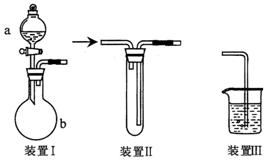
( l )甲同学认为利用装置II 直接收集NH3 、H2但不能收集O2,其理由是:
______________________________________________________________________。
( 2 )乙同学认为装置I 可作为实验室制氧气的快速发生器,对装置II 稍作改进后即可作为O2的收集装置,乙同学对装置II的改进方法是:_____________________________
___________;制O2时在装置I 中的a 中加人________,b 仪器中加人________________。
( 3)丙同学认为装置I 和装置III 可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置I 中a 仪器中加人_______________试剂,b 仪器中加人______________试剂,装置III 中应加人_________________________试剂,根据装置III中观察到的________
______________________________________实验现象即可得出C12
的氧化性比Br2强的结论。欲提取纯溴,还需进行的实验操作有__________________________________________。
27.( 14 分)已知A 一F 是中学化学中常见物质,其中A 、C 、E 、F 为气体,B 、D 为液体,D 的消费量常作为一个国家工业发达水平的一种标志,F 的浓溶液与X 共热通常用于实验室制备单质C , X 是一种黑色粉末,B 分子中有18 个电子。反应中部分生成物已略去。
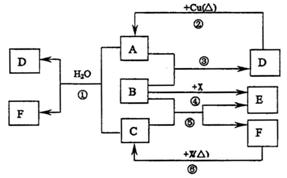
试回答下列问题:
( l )写出B 的电子式为_________________________________________
( 2 )写出反应② 的化学方程式:________________________________________
( 3 )写出反应① 的离子方程式:________________________________________
( 4 )写出反应⑥ 的离子方程式:________________________________________
( 5 )根据图中信息,B 、C 、D 、X 四种物质的氧化性由强到弱的顺序是(用化学式回答)_____________________________________________________________。
28、Ⅰ、在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得如下数据:
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
请回答下列问题:
(1)上表中“待测数据”的数值是_______________,此密闭容器内反应类型属于_________________(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比是n(X):n(Y):n(Z):n(Q)
=2:4:4:1,写出化学反应方程式____________________________________。
(3)反应结束后若将反应体系内的Y物质取出,在标准状况下测定其体积小于11.2L,其原因是_________________________________________________________。
Ⅱ、A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出下列元素的元素符号:B ,D ;
(2)E的最高价态与A、B、C三种元素形成酸式盐Y的化学式是 ,该盐在水溶液中离子浓度由大到小的顺序是 。
(3)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,这两种溶液中由水电离出来的H+浓度之比为c(H+)1∶ c(H+)2 = 。
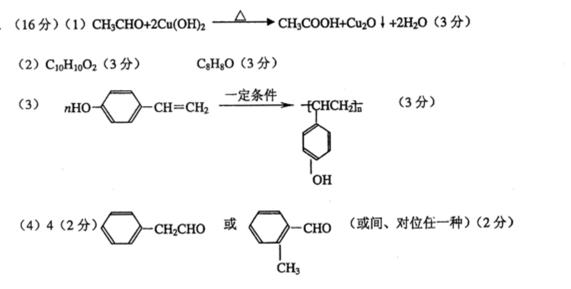
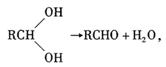 29.( 16 分)已知一个碳原子上连有两个羟基时,易发生如下转化:
29.( 16 分)已知一个碳原子上连有两个羟基时,易发生如下转化:
根据下图各物质之间的转化回答问题:
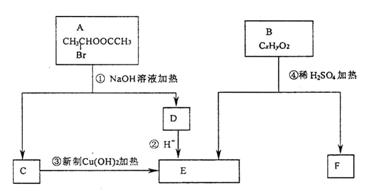
( 1 ) C 跟新制的 Cu (OH)2反应的化学方程式为________________________________
( 2 )已知 B 的相对分子质量为 162 ,其燃烧产物中 n ( CO2 ) : n ( H2O) = 2 : 1 。则 B 的分子式为________________, F 的分子式为_______________。
( 3 ) F 具有如下特点: ① 能跟 FeC13 溶液发生显色反应; ② 能发生加聚反应; ③ 芳环上的一氯代物只有两种。 F 在一定条件下发生加聚反应的化学方程式为
__________________________________________________________________
( 4 )化合物 G 是 F 的同分异构体,它属于芳香族化合物,能发生银镜反应。 G 可能有________种结构,写出其中任一种同分异构体的结构简式_______________________
分)。
答案:
选择题
6 C 7 C 8 D 9 B 10 A 11 B 12 D 13 C
26.Ⅰ(10分)(1)Cu + 4H+ + 2NO3- = Cu2+ + 2 NO2↑+ 2H2O。
(2)①可以控制反应。②吸收NO2气体,防止污染环境。 (3)关闭c;打开a、b。
(4)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分) (5)1/Vm mol·L-1

Ⅱ
27
28.Ⅰ(1)21.4,分解 (2)4HNO3=4NO2↑+O2↑+2H2O
(3)因为2NO2≒N2O4存在的平衡,有部分NO2转化为N2O4使气体体积缩少。
Ⅱ、(12分) (1)B N ,D Na ;(各2分)
(2)NH4HSO4(2分)
c(H+)> c(SO42-)> c(NH4+)> c(OH-)(3分)
(3)102a-14(3分)
29