高三化学补习班考前热身题
6.下列有关环境保护的说法错误的是
A.为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量
B.含N、P的化合物大量排放可使水体富营养化而产生“水华”现象
C.甲醛、苯及其同系物等是劣质建筑材料和装修材料释放的常见污染物,对人体非常
有害
D.废旧电池的集中处理是为防止电池中的汞、镉、铅等重金属对土壤和水源造污染
7.短周期元素中若两种元素的原子序数相差8,则它们
A.一定是同主族元素 B.周期数相差1
C.只能形成1:1型化合物 D.只能形成1:2型化合物
8.下列反应离子方程式书写正确的是
A.鸡蛋壳在醋酸中溶解有气泡产生
CaCO3+2H+ Ca2++H2O+CO2↑
B.硫酸亚铁溶液中加入过氧化氢溶液
Fe2++2H2O2+4H+ Fe3++4H2O
C.偏铝酸钠溶液加入过量盐酸
AlO2—+4H+ Al3++2H2O
D.水玻璃与盐酸反应
Na2SiO3+2H+ H2SiO3↓+2Na2+
9.下列有关阿伏加德罗常数(NA)的叙述中,正确的是
A.常温常压下22.4L C2H4中含有6NA个C—H键
B.电解精炼铜中当有6.4g精铜析出时,电路中有0.2NA个电子转移
C.用V2O5作催化剂,在密闭容器中加热1mol O2和2mol SO2可生成2NA个SO3分子
D.18g D2O中含有的电子数为10NA
|
水处理的新技术。已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O有关该反应的叙述正确的是 ( )
| |
B.Na2FeO4是一种氧化性比Na2O2更强的氧化剂
C.3molNa2O2发生反应时,有12mol电子发生转移
D.在Na2FeO4中Fe为+6价,其还原产物为Fe3+,Fe3+水解生成氢氧化铁胶体还有净水作用
11.将CO2分别通入下列物质的溶液中,溶液会变浑浊的是 ( )
①饱和Na2CO3 ②Na2SiO3 ③NaAlO2 ④CH3COONa
⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3 ⑧C6H5ONa
A.①②③④⑦ B.①②⑤⑦⑧ C.①②③⑤⑧ D.②③⑤⑥⑧
12.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)> c(Na+)>c(H+)>c(OH-),其可能的情形是 ( )
A.该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.该溶液可以由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)> c(Na+)+c(H+)
D.在上述溶液中加入适量NaOH,离子浓度大小可改变为
c(CH3COO-)> c(Na+)>c(OH-)>c(H+)
13. 已知在一定条件下有![]()
![]()
![]()
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的![]() ,在催化剂存在的条件下,高温加热,发生如下反应:
,在催化剂存在的条件下,高温加热,发生如下反应:
![]() ;
;![]()
反应达平衡后,测得![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 反应放出的热量为![]()
B. 平衡时![]() 的转化率为40%
的转化率为40%
C. 若将容器的体积压缩为1L,有利于该反应平衡正向移动
D. 判断该反应达到平衡的依据是![]() 、
、![]() 、
、![]() 、
、![]() 的浓度都相等
的浓度都相等
26.(15分)已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在下图转化中E均起催化作用(某些产物已略去)。
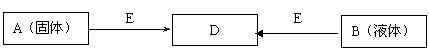
又知C、F、H是中学化学常见的三种物质,它们之间的相互转化关系如下图(部分反应条件及产物略去):
请回答:
(1)E的化学式可能为 ;
(2)若C是一种金属,H是淡黄色固体,则在实验室中C应该保存在____________
(3)若H是红棕色气体,则C电子式可能为______________.
(4)若C、F、H均为有机物,且F、H均能够与银铵溶液在一定条件下发生银镜反应。则F、H中含有的官能团是________ (写名称).写出F在一定条件下发生聚合反应的化学方程式 ,
其链节为 。
27.(14分)X、Y、Z为原子序数由小到大排列的三种短周期元素。已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨。
请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料。W的化学式为 ;
工业制造W的生产过程主要分为三个阶段。
①D 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式 ;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压。从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母) ;
A.400℃~500℃ 10 MPa B.400℃~500℃ 1 MPa
C.500℃~600℃ 10 MPa D.400℃~500℃ 0.1 MPa
|
转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
。
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂。
①写出X单质与W的浓溶液反应的化学方程式 ;
②500℃,11.2 L(标准状况)ZY2在催化剂作用下与XY发生化学反应。若有2×6.02×1023个电子转移时,该反应的化学方程式是 。
28.(14分)镁、铝、铁是重要的金属,在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 ;
(2)铝与氧化铁发生铝热反应的化学方程式为 ;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应为 ;
(4)在海洋工程上,通常用铝合金(Al—Zn—Cd)
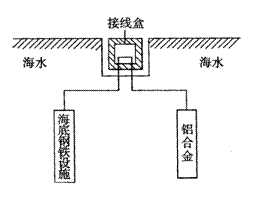 保护海底钢铁设施,其原理如图18所示:
保护海底钢铁设施,其原理如图18所示:
其中负极发生的电极反应为
;
在实际应用中,用铝合金而不选用纯铝。
纯铝不能很好地起到保护作用,其原因是
。
(5)将11.9g Mg—Al—Fe组成的合金溶于足量NaOH溶液中,合金质量减少2.7g。另取等质量的合金溶于过量的稀硝酸中,生成6.72L(标准状况)NO,向反应后的溶液中加入适量的NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为 g
29.(17分)已知:
| 名称 | 化学式 | 颜色、状态 | 溶解性(g) | 熔点(℃) | 密度(g/cm3) |
| 乙二酸 | H2C2O4 | — | 8.6(20℃) | 189.5 | 1.900 |
| 二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
注:乙二酸( HOOC—COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。
根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象是 ,说明乙二酸的酸性比碳酸 (填“强”或“弱”)。
(2)向盛有5mL乙二酸饱和溶液的试管里滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为 ,说明乙二酸
有 性。
(3)向A试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图甲连接好装置,加热3—5min,在B管中有油状且带有香味的液体产生,该现象说明发生
了 反应(填有机反应类型)。在B试管中加入饱和Na2CO3溶液的目的是
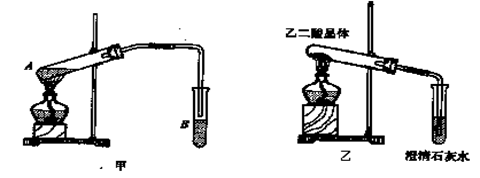 ,导管在液面上的原因是 。
,导管在液面上的原因是 。
(4)已知草酸分解的化学方程式为:![]() ,
,
用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因 (从下列序号中选择)。
a.草酸晶体的熔点低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察
b.因为加热的是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否还有其他分解产物
c.在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰
(5)该装置也不符合绿色化学的要求,试说明原因 。
参考答案
6.A 7.B 8.C 9.B 10.D 11.C 12.B 13.B
27.(14分)
(1)H2SO4………………………………………………………………………………(2分)
①S(s)+O2(g) SO2(g);△H=-297kJ/mol(有“点燃”条件给分)………(3分)
②D………………………………………………………………………………………(2分)
|
|
②SO2+2CO S+2CO2……………………………………………………………(3分)
|
(2)2Al+Fe2O3 AlO2O3+2Fe………………………………………………………(2分)
(3)2H2O+O2+4e- 4OH-…………………………………………………………(2分)
(4)Al-3e- Al3+……………………………………………………………………(2分)
铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能。…………………………………………………………………………(3分)
(5)27.2………………………………………………………………………………(3分)
29.(17分) (1)有无色气泡产生 (2分) 强 (1分)
(2)高锰酸钾溶液紫色褪去 (2分) 还原(2分)
(3)酯化(取代)(1分)吸收乙醇,除去乙酸,降低乙酸乙酯溶解度,并有利于分层
(3分)(答出其中一点且叙述合理得1分) 防止倒吸(或防止B中液体倒吸至A中)(1分)
(4)a、b、c(3分)
(5)产生的CO有毒,未经处理、吸收,会污染空气(2分)(其他合理答案均给分)
 压强/MPa
压强/MPa