高三化学补漏题
一、选择题
1.下列说法正确的是
A.氯水、氨水、水银均为混合物
B.O2、O3可能互为同位素
C.CH2O、C2H4O可能互为同系物
D.淀粉、纤维素可能互为同分异构体
2.下列说法正确的是
A.分解、潮解都是物理变化;风化、酯化都是化学变化
B.NH3分子之间易形成氢键;H、Cl原子之间易形成极性共价键
C.用电解法可以制得Na、Al;用热还原法可以制得Ag、Hg
D.活化分子一定可以发生有效碰撞;增加活化分子的百分数就可以加快化学反应速率
3.在一定条件下,氢气与氮气混合发生反应,下列有关说法正确的是
①因为增大压强,反应速率加快,平衡正向移动,所以在生产中压强越大越好
②降低温度,平衡正向移动,但是反应速率减慢,所以温度要选500℃
③使用铁触媒可以大大加快反应速率
④将氨变成液体,及时从平衡混合气中分离出去,可以使平衡正向移动
⑤氮气、氢气要循环使用,增加氮气的量,可以提高氢气的转化率,但氮气的转化率会降低
⑥可以选用的催化剂很多,且催化剂可以提高平衡转化率
A.③④⑤ B.①③⑤ C.②④⑥ D.③④⑥
4.下列关于糖的说法中正确的是
A.符合Cn(H2O)m通式的物质一定属于糖类
B.不符合Cn(H2O)m通式的物质一定不属于糖类
C.1 mol 麦芽糖发生水解反应,可以生成1 mol葡萄糖和1 mol果糖
D.淀粉、纤维素的通式均为(C6H10O5)n,均为天然高分子化合物
5.下列说法正确的是
A.蛋白质属于天然高分子化合物,组成元素只有C、H、O、N
B.用浓Na2SO4、CuSO4溶液或浓HNO3溶液使蛋清液发生盐析,进而分离、提纯蛋白质
C.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应
D.甘氨酸(H2N-CH2-COOH)既有酸性,又有碱性,是最简单的氨基酸
6.下列说法不正确的是
A.油脂是高级脂肪酸的甘油酯
B.油脂与氢气发生加成反应,可以得到硬化油
C.油脂在酸性或碱性条件下,可以发生皂化反应
D.日常使用的花生油、豆油、动物油都是油脂,它们能溶解一些脂溶性维生素
7.煤的主要成分是碳(C),下列关于煤的说法不正确的是
A.煤的形成需要经过上亿年时间,不可再生
B.煤是发热量很高的固体燃料,开采成本较低,用煤做燃料很好
C.煤是重要的化工原料,应该综合利用
D.煤直接燃烧时产生二氧化硫等有害气体和烟尘,对环境造成严重污染
8.下列关于中和热的说法正确的是
A.酸跟碱中和生成1 mol H2O时放出的热量
B.稀溶液中,酸跟碱发生中和反应时的反应热
C.在稀溶液中,1 mol强酸跟强碱发生中和反应生成H2O时的反应热
D.常温时,当强酸跟强碱在稀溶液中发生中和反应时,每生成1 mol H2O,都放出
57.3 kJ的热量
9.在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是
①氯化铝溶液中滴加氢氧化钠溶液
②偏铝酸钠溶液中加盐酸
③氢氧化钠溶液中滴加氯化铝溶液
④蛋白质溶液中滴入硫酸铜溶液
⑤氯化铝溶液中滴加氨水
⑥硝酸银溶液中滴加氨水
⑦氢氧化铁胶体滴加硫酸
A. ①②⑥⑦ B. ②③⑤⑦ C. ①②④⑥ D. ③④⑤⑥
10.下列离子方程式书写正确的是
A.苯酚钠溶液中通入二氧化碳气体 C6H5O-+CO2+H2O→C6H5OH+CO32-
B.醋酸铵溶液和盐酸反应 CH3COONH4+H+ = CH3COOH+NH4+
C.向乙醇中加入金属钠 2CH3CH2OH+2Na→2CH3CH2ONa+ H2↑
D.向澄清石灰水中加入过量的碳酸氢钠溶液 Ca2++2OH-+2HCO3-= CaCO3↓+2H2O+CO32-
11.珊瑚虫是海洋中的一种腔肠动物,它们可以从周围的海水中获取Ca2+和HCO3-,经反应形成石灰石的外壳:Ca2++2 HCO3-![]() CaCO3+CO2↑+H2O。下列情况可以促进CaCO3产生的是
CaCO3+CO2↑+H2O。下列情况可以促进CaCO3产生的是
A.珊瑚周围有藻类植物生长
B.人类大规模砍伐森林
C.燃烧煤及其他的化石燃料
D.有更多的人潜水观看珊瑚
二、非选择题
1.如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
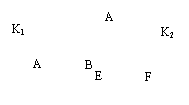 |
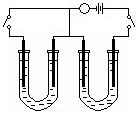
NaCl溶液 NaCl溶液
(1)打开K2,合并K1。
B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
E为 极,F极的电极反应为 ,检验F极产生气体的方法是 。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 ,原因是
。
2.(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,下图表示上述反应能量变化的理论分析示意图:
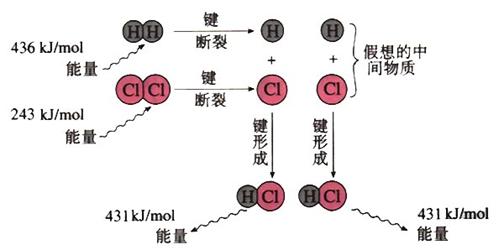
①化学键断裂需要 (填“释放”或“吸收”)能量;
②图中共释放的能量 kJ/mol;
③该反应的反应物的总能量 (填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是 反应;
④用图示数据计算其反应热,写出该反应的热化学方程式
。
(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时
C(s,石墨) + O2(g) = CO2(g);ΔH1 = - 393.5 kJ/mol
CO(g) + ![]() O2(g) = CO2(g);ΔH2 = - 283.0 kJ/mol
O2(g) = CO2(g);ΔH2 = - 283.0 kJ/mol
写出石墨在氧气中反应生成一氧化碳的热化学方程式
。
3.A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其它非金属元素化合时易形成共价键,F与其它非金属元素化合时易形成离子键,且F+离子与E2-离子核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于 周期, 族;
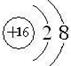
(2)G的离子结构示意图 ;
(3)用电子式表示D2的形成过程 ;
(4)由A、E、F三种元素形成的化合物的化学式为 ,含有的化学键有 (填写完整化学键类型),属于 晶体;
(5)B的最高价是 ,由A、B组成的化合物中,含A量最高的物质的化学
式是 ,含B量最高的物质的化学式是 (写出两种)。与D2式量相等的物质的化学式是 ,含有的化学键有 (填写完整化学键类型),属于 晶体,有 对共用电子对。
4.某校化学小组同学设计以下装置,进行不同的实验。其中a为用于鼓入空气的气囊, b为铜丝螺旋,c为喷有少量碱液的棉花,d中盛有冰水。

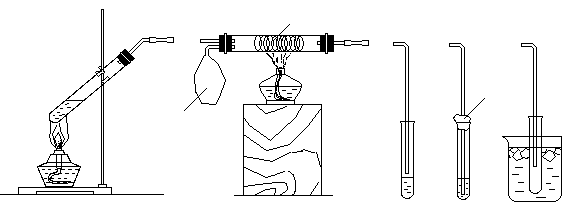
(1)若选用A装置做乙醛与新制氢氧化铜反应的性质实验,需去掉的仪器是 。制备新制氢氧化铜的正确操作是在试管里加入10%的 (填写化学式)溶液2 mL,滴入2%的 (填写化学式)溶液4~6滴,振荡。乙醛与新制氢氧化铜反应的化学方程式为
。
(2)若用A装置做乙醇与乙酸酯化反应的实验,则还需连接的仪器是(填序号) ,该仪器中应加入的试剂是 。要加快酯化反应的速率,采用的措施是 。写出含18O的乙醇与乙酸反应的化学方程式
。
(3)该小组同学欲做浓硫酸与铜反应的实验,并检验产生的二氧化硫。他们应选用的装置是 ,用于检验产物二氧化硫可选用的试剂是 ,在所选装置中(填序号) 部分是为了减少二氧化硫对空气的污染。
(4)该小组同学欲做乙醇氧化成乙醛的实验,他们可选用的装置是 。用制得的乙醛溶液再进行银镜反应,正确的操作顺序是(按先后顺序填写序号) 。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管里加入1 mL 2%的AgNO3溶液
写出该银镜反应的化学方程式
。
(5)该小组同学欲用A装置做铜与浓硝酸反应的实验,请你判断该实验是否可行
(填“是”或“否”),其原因是 。
5.菠菜中有含铁元素的物质和乙二酸。乙二酸俗称草酸,易溶于水。其主要物理常数如下:
| 名称 | 分子式 | 颜色、状态 | 溶解性(g) | 熔点(℃) | 密度 (g/cm3) |
| 乙二酸 | H2C2O4 | 无色 | 8.6(20℃) | 189.5 | 1.900 |
| 二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | —— | 101.5 | 1.650 |
某化学小组同学为了研究草酸(乙二酸的结构HOOC—COOH)的化学性质,进行以下实验。
(1)该小组同学向盛有5mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为 ;由此可推知乙二酸具有 (填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是 ;
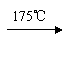 |
(2)已知草酸分解的化学方程式为H2C2O4 H2O+CO2↑+CO↑。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。

 | |||||||
| |||||||
| |||||||
| |||||||
实验前,有同学提出用草酸晶体进行实验,遭到大家的反对,其原因是
;
有同学提出这个实验不能检验二氧化碳气体,还需在B、C之间加入4个D装置,依次加入的试剂是 、
和浓硫酸,其中第3个D装置的作用是 。
6.某校学生小组进行硫酸铜晶体里结晶水含量的测定实验,其实验步骤如下:
①用坩埚准确称取2.0 g硫酸铜晶体,记下坩埚和硫酸铜晶体的总质量m1;
②将盛有硫酸铜晶体的坩埚放在三角架上面的泥三角上,缓慢加热,直到蓝色的硫酸铜晶体完全变成白色,且不再有水蒸气逸出,然后将坩埚冷却;
③待坩埚冷却后,将坩埚放在天平上称量,记下坩埚和无水硫酸铜的总质量m2。
(1)②中加热硫酸铜晶体时所用的仪器有 。
(2)上述每一步实验中,都有一个很关键的步骤没有给出,它们是① ;② ;③ 。
(3)写出硫酸铜晶体(CuSO4·xH2O)中结晶水的表达式x= 。
(4)该小组最终测定的结果偏高,其原因可能是(选填字母序号) 。
A.取出的硫酸铜晶体未研成粉末,就开始加热
B.在①中称量坩埚和硫酸铜晶体时,天平指针偏右
C.加热时,硫酸铜晶体刚变为白色,就停止加热
D.将加热后的白色粉末放在空气中冷却
7.在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)检验溶液中是否含有K+的操作是
;
(3)待测液中一定存在 ;
(4)待测液中一定不存在 ;其原因是
;
(5)写出溶液C与过量氨水反应的离子方程式
。
高三化学补漏题参考答案
一、选择题
1.C 2.B 3.A 4.D 5.D 6.C 7.B 8.D 9.A
10.D 11.A
二、非选择题
1.(1)负 O2 + 2H2O + 4e- = 4OH- 溶液中有红褐色沉淀生成
2Fe+ O2 +2H2O =2Fe(OH)2 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阴 2Cl- - 2e- = Cl2↑
用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
(3)AE
因为 A极产生OH-;E极中H+反应了,促进了水的电离,溶液中有OH-剩余。所OH-遇酚酞变红
2.(1)①吸收 ②862 ③大于 放热
④ H2(g) + Cl2(g) = 2HCl(g);ΔH = -183 kJ/mol
(2)C(s,石墨) + ![]() O2(g) = CO(g) ;ΔH = -110.5 kJ/mol
O2(g) = CO(g) ;ΔH = -110.5 kJ/mol
3.(1)3 ⅠA
(2) (3)
(3)![]()
(4)NaOH 离子键和极性共价键 离子晶体
(5)+4 CH4 C2H2 、C6H6 C2H4 极性键和非极性键 分子晶体 6
|
CH3CHO + 2Cu(OH)2
![]() CH3COOH + Cu2O
+ 2H2O
CH3COOH + Cu2O
+ 2H2O
(2)C 饱和碳酸钠溶液 加热和加入浓硫酸做催化剂
|
|
(3)AD 品红(答案合理即可) c
(4)ABE ④②①③
|
CH3CHO +2Ag(NH3)2OH![]() CH3COONH4
+2Ag ↓+3NH3 +H2O
CH3COONH4
+2Ag ↓+3NH3 +H2O
(5)否 因为浓硝酸受热分解,且浓硝酸与铜在常温下反应已经很快
5.(1)紫色高锰酸钾溶液褪色 还原性 Fe2+
(3)草酸晶体的熔点低,未分解之前就已熔化并流到试管口处,不能完成分解实验。
澄清石灰水 氢氧化钠溶液 澄清石灰水 检验CO2是否除净
6.(1)坩埚、泥三角、三角架、酒精灯、玻璃棒
(2)①将硫酸铜晶体研成粉末;②要放在干燥器中冷却;③多次加热至连续两次称量的质量差不超过0.1 g为止。
(3)![]()
(4)B
7.(1)NH3 Fe(OH)3
(2)用一支洁净的铂丝蘸取少量原溶液,在酒精灯上灼烧,透过蓝色钴玻璃,观察火焰焰色,若为紫色,则有K+存在
(3)NH4+、Fe3+、SO42-、 Al3+
(4)HCO3— 、Ba2+ 因为有Fe3+,所以没有HCO3—;因为有SO42-,所以没有Ba2+
(5)Al3+ + 3NH3·H2O = Al(OH)3 ↓ + 3 NH4+