高三化学调研考试题
注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共六道大题29道小题。满分150分,考试时间120分钟。
2.所有试题的答案都必须工整书写在答题卷上,否则无效。
3.第II卷第21题至第27题为必做题;第28题和第29题为选做题,考生可任意选做一题,若两题均做,一律按第28题计分。
4.可能需要的相对原子质量
H:1;C:12;N:14;O:16;Na;23;Mg:24;Cl:35.5;K:39;Fe:56;Cu:64
第Ⅰ卷(选择题,共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
(A)用木材、煤炭等作燃料 (B)用液氢替代汽油
(C)开发风能、地热 (D)开发核能、潮汐能
2.下列物质中,属于含有非极性键的共价化合物的是
(A)N2 (B)Na2O2 (C)C2H4(乙烯) (D)CH4
3.下列反应中生成物总能量高于反应物总能量的是
(A)三氧化硫溶于水 (B)碳酸钙受热分解
(C)天然气燃烧 (D)铝与稀盐酸反应
4.下列物质能通过化合反应直接得到的是:①Fe(OH)3 ②H2SO4 ③Na2CO3 ④FeSO4
(A)只有②③④ (B)只有②③ (C)只有①②④ (D)全部
5.下列说法正确的是
(A)废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
(B)乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
(C)钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
(D)凡含有食品添加剂的食物对人体健康均有害,不宜食用
6.主链含5个碳原子,且有2个支链(甲基、乙基各1个)的烷烃有
(A)5种 (B)4种 (C)3种 (D)2种
7.把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
(A)6∶3∶1 (B)6∶3∶2
(C)3∶2∶1 (D)1∶2∶3
8.某温度下,体积一定的密闭容器中进行如下可逆反应:
![]() X(g)+Y(g)
Z(g)+W(g);ΔH>0
下列叙述正确的是
X(g)+Y(g)
Z(g)+W(g);ΔH>0
下列叙述正确的是
(A)升高温度,平衡逆向移动
(B)当容器中气体压强不变时,反应达到平衡
(C)平衡后加入X,上述反应的ΔH增大
(D)平衡后加入少量W,逆反应速率增大
9.下列有关化学实验的叙述正确的是
(A)用待测液润洗中和滴定所要使用的锥形瓶
(B)配制FeCl3溶液时,向溶液中加入少量Fe粉和稀盐酸
(C)用稀盐酸洗涤盛放过石灰水的试剂瓶
(D)NaOH溶液保存在带玻璃塞的试剂瓶中
10.分类方法在化学学科发展中起到了非常重要的作用。下列分类标准合理的是:①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等;②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
(A)①③ (B)②④ (C)①②④ (D)②③④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11.下列反应的离子方程式书写正确的是
(A)氯化铝溶液中加入过量氨水:Al3++4NH3•H2O = AlO2—+4NH4++2H2O
(B)澄清石灰水与过量小苏打溶液混合:Ca2++2OH—+2HCO3—= CaCO3↓+CO32—+2H2O
(C)碳酸钙溶于醋酸:CaCO3+2H+ = Ca2++CO2↑+H2O
(D)氯化亚铁溶液中通入氯气:2Fe2++Cl2 = 2Fe3++2Cl—
12.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
(A)c(NH4+) = c(SO42-) (B)c(NH4+)>c(SO42-)
(C)c(NH4+)<c(SO42-) (D)c(OH-)+c(SO42-) = c(H+)+c(NH4+)
13.R、M、T、G、J为原子序数依次递增的同一周期主族元素,下列说法一定正确的是(m、n均为正整数)
(A)若M(OH)n+1为强碱,则R(OH)n也为强碱
(B)若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素
(C)若T的最低化合价为-3,则J的最高正化合价为+6
(D)若M的最高正化合价为+4,则五种元素都是非金属元素
14.将相同质量的铜分别和过量的浓硝酸、稀硝酸反应,下列叙述正确的是
(A)消耗硝酸的物质的量:前者多,后者少
(B)反应生成气体的颜色:前者浅,后者深
(C)反应中转移的电子总数:前者多,后者少
(D)反应后所得Cu(NO3)2的物质的量:两者相同
15.NA代表阿伏伽德罗常数,下列说法正确的是
(A)9gD2O中含有的质子数为5NA
(B)1molCaCl2中含有的离子数为3NA
(C)30g甲醛中含共用电子对总数为4NA
(D)71gCl2与足量NaOH溶液反应转移的电子数为2NA
16.已知某溶液中存在较多的H+、NO3-,则该溶液中还可能大量存在的离子组是
(A)Mg2+、Fe2+、SO42- (B)Ba2+、NH4+、Br-
(C)Al3+、HCO3-、Cl- (D)Na+、SiO32—、ClO-
17.下列反应中,氧化剂与还原剂物质的量的关系为2∶1的是
(A)2H2S+SO2 = 3S↓+2H2O (B)2Na+O2 = Na2O2
(C)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
(D)2CH3COOH+Ca(ClO)2 = 2HClO+Ca(CH3COO)2
18.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减小,其方法是
(A)通入过量二氧化硫气体 (B)加入少量水稀释
(C)通入氯化氢气体 (D)加入饱和石灰水溶液
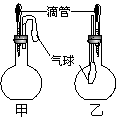 19.如图所示的甲、乙两个装置中,胶头滴管
19.如图所示的甲、乙两个装置中,胶头滴管
中吸入某种液体,平底烧瓶中充入(或放入)另一种
物质,挤压胶头滴管加入液体,一段时间后两装置
中的气球都有明显的胀大(忽略液体体积对气球的影
响)。则所用试剂可能分别依次是
(A)甲:浓硫酸和木炭 乙:浓氨水和HBr
(B)甲:双氧水和MnO2 乙:NaOH溶液和NO2
(C)甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
(D)甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气
20.可用下列示意图像表示的是
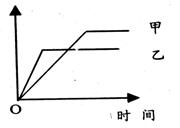
| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 等质量的钠、钾分别与足量乙醇反应 | H2质量 | 钠 | 钾 |
| B | 在同一容器中一定质量的氨气分解 | 氨气的 转化率 | 500℃ | 400℃ |
| C | 体积比1∶3的N2、H2在体积可变的恒压容器中合成氨 | 氨气的 浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2与lmolO2在相同温度下化合 | SO3物 质的量 | 10个 大气压 | 2个大气压 |
第Ⅱ卷(非选择题,共80分)
三、(本题包括3小题,共32分)
21.(10分)
(1)一般所谓“无水”乙醇,含乙醇约99.5%,还有约0.5%的水。当特殊需要而要求进一步除去水时,常采用如下操作:置5g镁条和0.5g碘(碘作催化剂)于一恰当容量的烧瓶中,倾入50~75mL“无水”乙醇,逐渐加热,此时有小气泡不断从混合液中逸出,继续加热回流直至镁条完全溶完,成为乳白色浆液。再倾入900mL“无水”乙醇,回流30min,然后直接蒸出乙醇,这样得到的乙醇其含量可以达到99.95%。试回答:
上述操作应选取的烧瓶的容积为 (选填序号)
(A)2L (B)1L (C)0.5L (D)0.2L
做出以上选择的理由是:
(2)亚硝酸钠可用作水泥施工的抗冻剂。它易溶于水,有咸味,既有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定且比醋酸的酸性还要弱的弱酸,亚硝酸只能存在于冷的稀溶液中,在浓溶液中或受热时易发生如下的分解反应:3HNO2 = 2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法所使用的试剂和据以鉴别它们的现象。
方法一(只用一种试剂):
方法二:
22.(8分)分别将等质量的铜片与等体积且均过量的浓硝酸、稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色,有同学提出溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量的浓硝酸,其产生的黄色与蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
为了验证该同学的推断是否正确,甲、乙、丙三位同学各设计了一个实验方案。
甲同学的方案:将盛绿色溶液的试管加热,看是否有红棕色的气体产生。
(1)你认为甲同学的方案的不妥之处是什么?应该作怎样的修正(实验装置及方法不变)?
乙同学的方案:用双氧水和二氧化锰制得氧气,并把氧气通入绿色溶液中,观察其溶液是否变蓝色。
(2)请用化学方程式表示其中的化学反应原理。
丙同学的方案:在通风橱内,将一根下端弯成螺旋状且可抽动的铜丝插入盛有足量浓硝酸的试管A中,立即可观察到试管中充满红棕色的NO2气体。将NO2气体经导管通入到倾斜的另一支装有淡蓝色Cu(NO3)2溶液的试管B中,随着实验进行,试管B中的溶液蓝色加深,很快又转变为绿色,继续通入NO2,绿色保持不变,向上抽起铜丝,使反应停止。
(3)简述丙同学的方案中的溶液变色的原因。
(4)从环保的角度看,你认为三个方案中最好的是哪一个?说明理由。
23.(14分)现有一份Fe2O3与CuO的混合物,欲用CO还原法测定其中Fe2O3的质量分数ω(Fe2O3)。制取CO可用乙二酸晶体在浓硫酸作用下加热生成CO、CO2,然后用纯净的CO还原混合物。实验中测定以下数据:反应前混合物的质量m1;反应后混合物的质量m2。
可供选择的实验用品有:18mol/LH2SO4溶液、6mol/LBa(OH)2溶液、蒸馏水、乙二酸晶体、NaOH溶液、CaCO3、NaCl、Fe2O3与CuO的混合物,常用仪器等
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (1)请设计并绘制一个实验装置示意图(假定每步反应和杂质吸收均是完全的)。各仪器分别用下列代号表示(玻璃管口之间的联结胶管不必画出):敞口玻璃容器 ;有塞玻璃容器 或 ;普通漏斗 ;分液漏斗 ;酒精灯 ;玻璃导管 或 ;并用A、B、C……依次给各仪器标号。
(1)请设计并绘制一个实验装置示意图(假定每步反应和杂质吸收均是完全的)。各仪器分别用下列代号表示(玻璃管口之间的联结胶管不必画出):敞口玻璃容器 ;有塞玻璃容器 或 ;普通漏斗 ;分液漏斗 ;酒精灯 ;玻璃导管 或 ;并用A、B、C……依次给各仪器标号。
(2)请写出示意图上用A、B、C……标示的各容器中盛放的物质的名称:
A B C D E ……
(3)请用m1和m2表示求ω(Fe2O3)的计算式:ω(Fe2O3) =
四、(本题包括2小题,共20分)
![]()
![]() 24.(10分)A、D为短周期元素的单质,B、C为化合物,C遇水能产生无色气体。一定条件下它们之间的转化关系如下图所示:
24.(10分)A、D为短周期元素的单质,B、C为化合物,C遇水能产生无色气体。一定条件下它们之间的转化关系如下图所示:
A B C
(1)试判断下列两种情况下A、B、C、D的化学式。
C遇水所得溶液不能使酚酞试液变红:A B C D
C遇水所得溶液能使酚酞试液变红:A B C D
(2)写出两种情况下的C分别与水反应的化学方程式
25.(10分)
(1)恒温下密闭容器中的可逆反应:xA(g)+yB(g)![]() zC(g)达到化学平衡时增加C的物质的量,一段时间后重新达到平衡,测得各物质的体积分数仍保持不变。若此反应的化学平衡常数K值为4,x、y为整数,z为2,A、B的起始浓度均为1mol/L,则C的平衡浓度为
mol/L。
zC(g)达到化学平衡时增加C的物质的量,一段时间后重新达到平衡,测得各物质的体积分数仍保持不变。若此反应的化学平衡常数K值为4,x、y为整数,z为2,A、B的起始浓度均为1mol/L,则C的平衡浓度为
mol/L。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g) △H<0
CO2(g)十H2 (g) △H<0
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
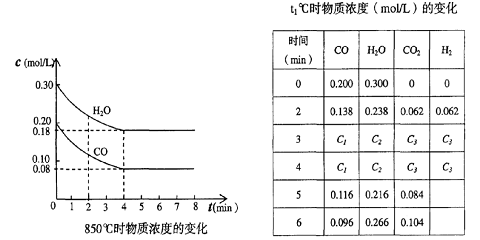
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_______0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是_____(单选),表中5min—6min之间数值发生变化,可能的原因是_______(单选)。
(A)增加水蒸气 (B)降低温度
(C)使用催化剂 (D)增加氢气浓度
五、(本题包括2小题,共18分)
26.(10分)
(1)化学反应的实质是“旧键的断裂,新键的形成”。在一定条件下,从一个乙醇分子中断键去掉两个氢原子可生成多种新的有机物。请尽可能多地写出这些有机物的结构简式。
(2)在将铜导线进行焊接时,往往要先除去导线表面上的氧化物锈斑。若是将导线烧热后在酒精里蘸一下,导线的表面就会变得既红又亮。写出有关反应的化学方程式。
(3)下列是一些制取物质的设想,请指出其中违背科学原理的一项,并简单说明错误的原因。
(A)用玉米、植物秸杆等作原料制造乙醇,用作汽车的燃料
(B)用动物的骨或皮作原料制造滋补品
(C)用淀粉作原料提取淀粉酶,用作催化剂
(D)用植物油或动物脂肪作原料制造甘油
27.(8分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质。经测定,该物质易溶于水,在水中以SO42—和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
(1)N4和N2的关系正确的是___________(填序号)
(A)同种单质 (B)同位素
(C)同分异构体 (D)同素异形体
(2)N4H4(SO4)2 ______ (填“能”或“不能”)和草木灰(主要成分为碳酸钾)混合施用。
![]() (3)已知液氨中存在着下列平衡:2NH3 NH4++NH2—。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________。
(3)已知液氨中存在着下列平衡:2NH3 NH4++NH2—。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________。
六、选做题(10分)
请注意:第28题和第29题为选做题,考生可在两题中任意选做一题。若两题均做,一律按第28题计分。
28.(10分)
(1)2005年冬,广东省环保部门监测发现,广东北江韶关段出现了重金属镉超标现象,北江发生严重的水体污染事件,专家确定用1200吨的聚合铁(简称PFS,化学式为:![]() )分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。
)分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。
①镉原子的外围电子排布为4d105s2,108Cd核素的中子数与质子数之差为 。
②PFS中铁显 价,铁原子的电子排布式是 。
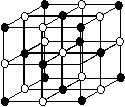 |
(2)氧化镁的晶胞结构(如图所示):
①晶体中的每个Mg2+的周围与它最接近的且距离相等的
Mg2+共有 个,每个O2—周围距离最近且相等的Mg2+
形成了一个 的空间结构。
②一个MgO晶胞中Mg2+和O2—的个数都是 。
③设MgO的摩尔质量为Mg/mol,MgO晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则MgO晶胞边长为
(3)NCl3是一种淡黄色的油状液体,NCl3分子中氮原子的杂化轨道类型是 杂化,分子的空间结构是 。
29.(10分)自2003年以来,中国、日本和越南相继爆发禽流感,随后禽流感又在全球蔓延,并造成多人死亡。世界卫生组织警告说,禽流感对人类的潜在威胁要远大于“非典”,可能导致全球经济大幅度的衰退。2005年瑞士罗氏制药公司介绍了抗禽流感药物“达菲”的生产工艺。合成“达菲”的重要中间体为莽草酸。为研究莽草酸的分子结构,人们设计如下实验:
(1)莽草酸是一种有机物,其相对分子质量不超过200,是一种白色粉末,易溶于水,难溶于氯仿和苯。取一定量样品燃烧,产物只有CO2和H2O且有n(CO2)∶n(H2O) = 7∶5,消耗的O2和生成的CO2的物质的量相等,则莽草酸的分子式为 。
(2)以下是以莽草酸为原料合成有机物B和D的路线:
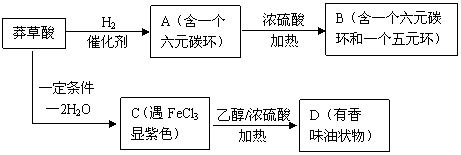 |
据此判断莽草酸分子中含有的官能团的名称: , , 。