高三化学适应性考试试题
化学试题
6.生活中的问题常涉及到化学知识,下列叙述中不正确的是
A.用汽油、煤油除去油污时发生的主要是物理变化
B.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.棉花、蚕丝和人造丝的主要成分是纤维素
7.下列离子方程式中书写正确的是
A.碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-==NH3·H2O
B.钠与水反应:Na+2H2O==Na++2OH-+H2↑
C.铜和稀硝酸反应:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
D.碳酸钠溶液显碱性:CO32-+2H2O=H2CO3+2OH-
8.设NA表示阿伏加德罗常数,下列叙述正确的是
A.在标准状况下,11.2LNO与11.2L O2混合后气体分子数为0.75NA
B.7.8g Na2O2与足量的CO2反应时转移的电子数为0.2NA
C.1L 1mol/L的醋酸溶液中所含离子总数为2NA
D.常温常压下,16g O3所含的原子数为NA
9.中学化学课本中有大量的数据。下面是某学生对数据的应用,其中不正确的是
A.用两种卤素离子的半径数据比较其还原性的相对强弱
B.用质量数数据比较元素金属性的强弱
C.用溶解度数据解释长时间加热Mg(HCO3)2溶液得到的固体是Mg(OH)2而不是MgCO3
D.用沸点数据推测用蒸馏的方法分离液体混合物的可能性
10.常温下下列反应均能自发地向右进行:2D—+A2=D2+2A—;2B—+D2=B2+2D—;2A—+C2=A2+2C—。由此得出的正确结论是
A.A—、B—、C—、D—离子中,还原性最强的是C—
B.反应2A—+B2=A2+2B—不能自发向右进行
C.A2、B2、C2、D2单质中,氧化性最强的是A2
D.反应2C—+B2=C2+2B—能够自发向右进行
11.右图是某学校实验室从化学试剂商店买回
|
说法正确的是
A.该试剂的物质的量浓度9.2mol·L-1
B.该硫酸50mL与足量的铜反应,被氧
化的铜的物质的量为0.46mol
C.配制250mL4.6mol·L-1的稀硫酸需取
该硫酸62.5mL
D.该硫酸与等体积的水混合所得溶液的质
量分数小于49%
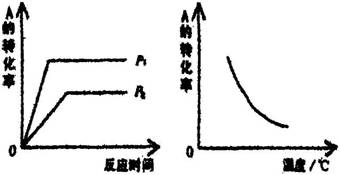 12.现有可逆反应:mA(g)+nB(g)=xC(g);
12.现有可逆反应:mA(g)+nB(g)=xC(g);
ΔH=akJ·mol-1。该反应在不同温度和压强(P1、P2)条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
A.a<0, m+n<x
B.a<0, m+n>x
C.a>0, m+n<x
D.a>0, m+n>x
13.关于下列各装置图的叙述中,不正确的是
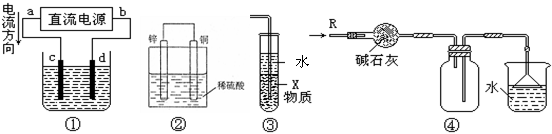
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
26.(12分)X、W、Y、Z代表原子序数依次减小的四种短周期元素,它们满足以下条件:X原子L层电子数是其最外层电子数的2倍;W原子K、L层电子数之和比L、M层电子数之和多1个电子;Y是自然界含量最多的元素;含Z元素的有机物之一,是含氢质量分数最高者。请填空:
(1)X元素位于元素周期表中第 族。X原子结构示意图为 。X的最高价氧化物形成的晶体属于 晶体;工业上冶炼X的化学方程式为
(2)W、Z两元素为什么不属于同主族元素? 。
(3)W、Y和Z可组成一种化合物,其原子个数比为2:4:2,写出该化合物的结构简式及名称: 、 。
(4)W和Y在加热时形成化合物,用电子式表示其形成过程
(5)ZY2的产生是由于 ,对环境的危害在于 。
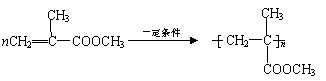
27.(18分,每空2分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
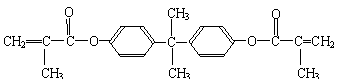
它在一定条件下水解可生成双酚-A和羧酸H两种物质。
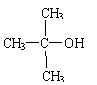 |
已知与 结构相似的醇不能被氧化为醛或酸。羧酸H可以由以下途径制得:
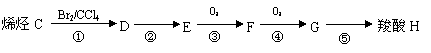 |
(1)双酚-A的分子式为 ;下列关于它的叙述中正确的是 (填写字母)。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中所有碳原子可能在同一平面上
D.与浓溴水反应,最多可消耗4mol Br2
(2)下列物质中与双酚-A互为同分异构体的是 (填写字母)。
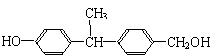 | |||
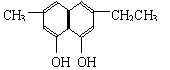 | |||
A. B.
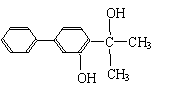 | |||
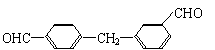 | |||
C. D.
(3)C的结构简式 ,其名称为 。
(4)G中所含官能团为 (填名称),⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:
。
28.(18分)现有一份含有FeCl3和FeCl2固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂 和
(3)实验2通入足量Cl2的目的是
涉及的化学反应的离子方程式是
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是:
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的特性。以下关于胶体的说法不正确的是
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能作布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为 。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)
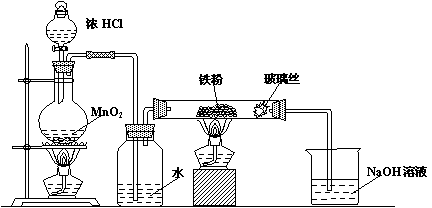

A B C D
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施
|
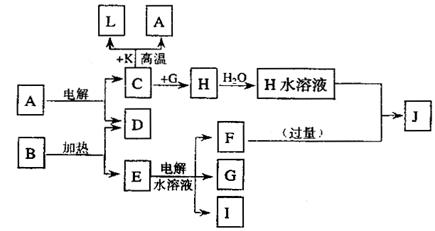
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃)。
请回答:
(1)I在G中燃烧时的现象为 。
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式 。
(3)已知K为红棕色粉末,写出C与K反应的化学方程式 ,
引发该反应的操作为 。
(4)J与H反应的离子方程式为 。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为 。
渠二中高三适应性考试
化学试题 参考答案
6、D 7.C 8.D 9.B 10、B 11、C 12、B 13、A
26.(1)IVA ![]() 原子
原子
(2)W、Z两元素原子的最外层电子数不相同
(3)NaOOC—COONa 乙二酸钠
27.(共18分,每空2分) (1)C15H16O2; D (2)A、C
(3) (4)羟基、羧基;消去反应
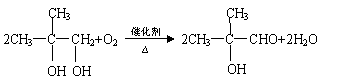 |
(5)
 |
(6)
28、(18分)
(1)烧杯、玻璃棒(2分,见错不给分)
(2)稀盐酸 铁粉(各1分)
(3)将Fe2+全部转化为 Fe3+ (2分) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-(2分)
(4)向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净。(2分)
(5)FeCl3 在水中存在如下平衡FeCl3 + 3H2O === Fe(OH)3 + 3HCl 。 在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3 固体。
(方程式1分,文字说明1分)
(6)C E(2分,见错不得分)
(7)2:3(2分)
(8)在B、C之间和C、D之间分别增加盛有浓硫酸的洗气瓶防止FeCl3 潮解(2分,答全给分,答不全不给分)
|
|
(3)2Al+Fe2O3 Al2O3+3Fe; 在Al和Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条
(4)Al3++3AlO![]() +6H2O=4Al(OH)3↓; 1:8
+6H2O=4Al(OH)3↓; 1:8
渠二中高三适应性考试理综
化学部分答卷
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
26.(12分)(1)第 族。 。 晶体;
(2) 。(3) 、 。
(4)形成过程
(5)ZY2的产生是由于 ,对环境的危害在于 。
27.(18分,每空2分)(1)分子式为 ;正确的是 ; (2) ;(3)C的结构简式 ,其名称为 。
(4)G中所含官能团为 (填名称),⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)
。
28.(18分)(1)玻璃仪器有 ;(2) 和
(3)目的是
离子方程式是
(4)方法是:
(5)原因
(6)不正确的是 ;(7)之比为 。
(8)改进措施
29.(12分)(1)现象为 。
(2)化学方程式 。
(3)化学方程式 ,
引发该反应的操作为 。
(4)J离子方程式为 。物质的量之比为 。