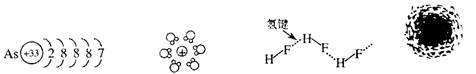高三化学重点高中押宝试题
考生注意 :
1. 本试题分试题卷和答题卡两部分。试题为六大题26 小题。满分150 分。考试时间120分钟。考试结束,考生只交答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 C1—35.5 Ca-40 Fe—56 Ba-137
—、单项选择题(本题包括8 小题,每小题4 分,共32 分. 每小题只有一个选项符合题意)
1.法新社2006年4月4日报道,天文学家在太空中发现一个长4630亿千米的甲醇气团,
这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力依据。下列有关甲醇的说法正确的是
A.甲醇能使蛋白质变性 B.甲醇能发生消去反应
C.甲醇不能被催化氧化 D.甲醇与钠反应比水与钠反应剧烈
2.用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确
的是 ( )
|
在通常状况下氢原子
砷原子结构示意简图 水合钠离子示意简图 HF分子间的氢键 电子云示意图
A. B. C. D.
3.以下性质的比较中,正确的是
A.原子半径:Cl>Na>O>N B. O3、O4(![]() )与O2的稳定性O4>O2> O3
)与O2的稳定性O4>O2> O3
C.熔点:NaF>NaCl>CCl4>CF4 D.热稳定性:HF>HCl>H2S>H2O
4.下列有关阿伏加罗德常数的叙述正确的是
A. 1L0.5mol·L-1的(NH4)2SO4溶液中含有NH4+个数约为6.02×1023
B.标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
C.1mol冰醋酸中含有6.02×1023个CH3COO-
D.标准状态下,含4mol HCl的浓盐酸与足量MnO2反应可生成22.4LCl2
5.共价键的断裂有均裂和异裂两种方式;
即:A∶B→A•+B• ,均裂; A∶B→A++[∶B]—,异裂。
下列化学方程式中发生共价键均裂的是
A.2K+2H2O=2KOH+H2↑ B.2Na+2C2H5OH→2C2H5ONa+H2↑
C.Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
D![]()
6.在含氧酸中有一种称为原某酸的,一般不稳定,易脱水;它与对应的含氧酸的区别在于H、O原子数目的不同。例如:硅酸的化学式H2SiO3,原硅酸的化学式为H4SiO4;碳酸的化学式为H2CO3,原碳酸的化学式为H4CO4,据此可推知,下列结构简式中属于原甲酸乙酯的酯类是
A.C(COC2H5)4 B.CO(OC2H5)2 C.H2C(COC2H5)2 D.HC(OC2H5)3
7.下列各组离子,在所给条件下能够大量共存的是
A.在AlCl3溶液中:Na+、CO32-、SO42-、NO3-
B.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
C.加入(NH4)2Fe(SO4)2·6H2O晶体的溶液中:Na+ 、H+ 、Cl- 、NO3-
D.水电离出的[H+]=1×10-10 mol/L溶液中:K+、HCO3-、Cl-、S2-
8.将物质的量均为a mol的钠和铝一同投入mg水中(水足量),所得溶液的密度为
ρg·cm-3,则此溶液的物质的量浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
二、不定项选择题(本题包括8 小题,每小趣4 分,共32 分。 每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0 分;若正确答案包拾两个选项,只选1 个且正确的给2 分,选两个且都正确的给满分,但只要选错一个该小题就为0 分)
9.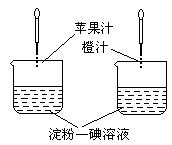 利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。
利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。
要得出正确结论,在实验时需要控制的条件是
A.实验时必须向两烧杯中同时滴加液体
B.淀粉—碘溶液的体积和浓度必须相等
C.胶头滴管滴出的果汁的滴数必须相等
D.胶头滴管滴出的每滴果汁的体积必须相等
10.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.25℃时,相同物质的量浓度的①NaHCO3 ②NaOH ③H2SO4 ④Na2CO3
溶液中,水的电离程度大小顺序是④>①>②>③
C.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末后,容器中有晶体析出,且溶液中c(H+)一定增大
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是仅含有离子键的离子型化合物
11.有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列叙述中正确的是
A.a、 b、c的化学式分别为Ne、Br2、HF
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
12.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
B.物质的量浓度c(甲)>10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
13. 下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H =—216kJ·mol-1 ,
反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H =—571. 6 kJ·mol-1 ,
H2的燃烧热为571.6 kJ·mol'
D.H+ (aq) +OH-(aq) =H2O(l) ;△H=—57.3 kJ·mol-' ,含 1molNaOH 的氢氧化钠
溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
14. 根据以下实验的检验所得出的结论可靠的是
A.常温下测定发现,等物质的量浓度H2CO3的pH大于H2SO3的pH,所以碳元素比硫元素的非金属性弱
B. 向无色溶液通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-
C.向淀粉溶液中加入稀硫酸加热,后取出少量加入一定的新制的氢氧化铜浊液,加热至沸腾,无砖红色沉淀产生,由此确定淀粉还未水解。
D. 向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
15.下列反应的离子方程式正确的是
A. 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.电解饱和食盐水:![]()
C.过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O
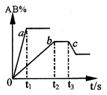 16. 右图是反应A2
+B2
16. 右图是反应A2
+B2![]() 2AB
在不同温度和压强下,AB体积
2AB
在不同温度和压强下,AB体积
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中只有一种为非气体,正反应吸热
D.从时间t3开始到重新达到平衡这段时间内,体系内的气体平均摩尔质量一定发生变化。
三、(本题包括2 小题,共23 分)
17.(11分)
⑴下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是 (填编号)。
⑵某同学为验证苯的沸点(80.1℃)比水低,以试管取用少量的苯放在水浴中,并在水浴中插一温度计。实验开始后,用酒精灯给水浴加热。
该实验有一个明显的缺点是什么?
应如何改进?
⑶为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,
充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序
为:______________________________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,
主要表现为: ____________________________________________________
18.(12分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷:
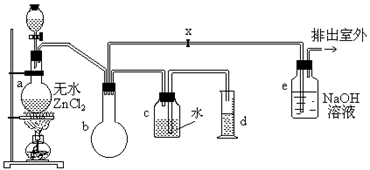
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式____________________________________________
(2)检验气体产物CH3Cl的方法是:____________________________________________
CH3Cl燃烧的化学方程式是____________________________________________
(3)实验中实际按甲醇和浓盐酸1:2(物质的量之比)进行反应的理由是
____________________________________________
(4)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是
____________________________________________
(5)实验结束后,d中收集到的液体中含有__________________________________________
四、(本题包括3 小题,共19 分)
19. ( 9 分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。
这类材料中研究较多的是化合物G。
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。
请推断:G 和E的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业
上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:
赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________
20. (10 分) 已知:A、B 是两种盐的溶液,其焰色反应均呈黄色,A 呈中性,B呈碱性并具有氧化性;D 在CCl4中呈紫红色。下图为相关实验步骤和实验现象
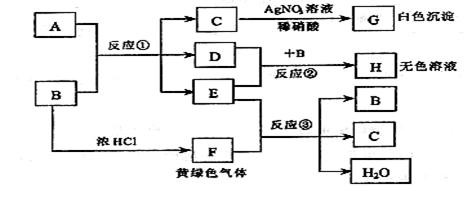
请回答:
(1) 依次写出 A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________
21.(10分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
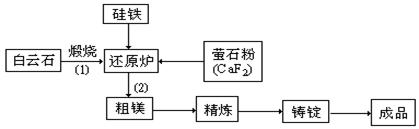
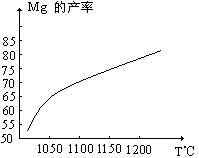 ⑴在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
⑴在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”)理由是 。
⑵还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
| 剩余压强mmHg | 760 | 10 | 1 | 0.1 |
| 平衡时的温度℃ | 2370 | 1700 | 1430 | 1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl••MgCl2• 6H2O),其中
KCl••MgCl2• 6H2O属于 。A.纯净物 B.混合物 C.配合物
⑷写出下列反应的方程式
①煅烧白云石 。②CaO•MgO与Si的反应 。
五、(本题包括2 小题,共22 分)
22.(10分)相对分子质量为94.5的有机物A,在一定条件下可以发生如下图所示的转化(其他产物和水已略去);
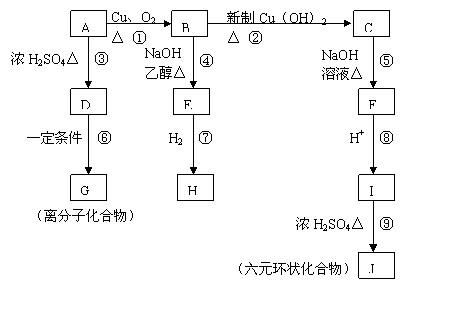
请回答下列问题:
(1)写出下列物质的结构简式:A ,J 。
(2)上述①—⑨的反应中, 是消去反应(填编号)。
(3)写出B→C的化学反应方程式:
。
(4)有机物I在一定条件下可合成一种环保高分子材料,则该高分子结构简式为
23.(10分)化学纤维是传统三大合成高分子材料之一,其中的涤纶和维尼纶至今仍在纺织业中作为重要的原料。涤纶、维尼纶的结构简式如下:
涤纶: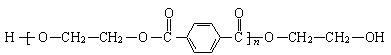
(分子链两端连接的H-、-O-CH2-CH2-OH是链的终止基团)
维尼纶: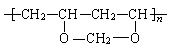 (链的终止基团已被省略)
(链的终止基团已被省略)
工业上用煤、石油等综合利用的产物生产涤纶和维尼纶。下面是合成所需基本原料的制备方法。
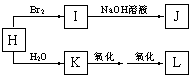
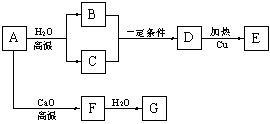
已知:A为单质,B、C、E、G、H通常情况下为气体。合成流程如下:
合成涤纶:
![]()
合成维尼纶:
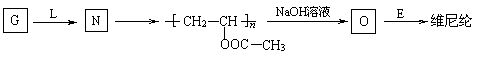
回答下列问题:
⑴G与L反应生成N的反应类型是________ ;
⑵合成涤纶的流程中,可以重复利用的物质的名称是______________ 。
⑶高分子化合物O (填“能”或“不能”)能溶于水,原因是_________________________;
⑷写出M和J反应生成涤纶的化学方程式(涤纶的结构中应含有终止基团):
____________ ;
⑸写出O与E反应生成维尼纶的化学方程式:
________________________________________ 。
六、(本题包括2小题,共14分)
24. (6 分) 近年来,工业上常用Mg(NO3)2替代浓硫酸作为制取浓硝酸的脱水剂(以下数据都为质量分数)。65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏,分别得到97.5%HNO3和60% Mg(NO3)2溶液(不含HNO3)。
(1)若蒸馏过程中HNO3、 Mg(NO3)2、H2O均无损耗,则求蒸馏前的投料比![]() 的值为____________________________________________。
的值为____________________________________________。
(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+ M2)×5.0%的H2O流失,则投料比![]() 应该__________________(选填“增大”、“减小”或“不变”)
应该__________________(选填“增大”、“减小”或“不变”)
25.(8分)《环境空气质量标准》中,有害气体的浓度常用标准状况下,每立方米气体中含有害气体的毫克值(mg/m3)来表示,对CO的浓度限值规定为:
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
① 首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2
(不考虑其他气体的反应);
② 用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,
发生的反应为:I2+2S2O32-=2I-+S4O62-
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下:
 |
(1) 写出①中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。
参考答案
一、1、A 2、D 3、C 4、B 5、D 6、D 7、B 8、C
二、9、BD 10、BC 11、AC 12、 B 13、AB 14、B 15、D 16、C
三、17.(11分)
⑴①③⑤(2分,漏选得1分,多选0分)
(2)苯挥发造成空气污染(1分),应在试管上加一单孔塞,孔中插一长直导管(1分)
(3)方案1:Fe3+>Cu2+>H+>Fe2+ (2分)
方案2: 阴 2Fe3++2e-=2Fe2+; Cu2++2e-=Cu ;
2H++2e-=H2↑; (3分)
①有污染性气体Cl2 产生 ② 使用了电解装置,成本较高;等。(2分)
18.(12分,每空2分)(1)【答:CH3Cl+HCl![]() CH3Cl+HCl】,
CH3Cl+HCl】,
(2)在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。
【答:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl】
2CO2+2H2O+2HCl】
(3)【答:可使甲醇充分反应,转化成一氯甲烷】
(4)【答:甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出】
(5)【答:甲醇、盐酸、一氯甲烷】
四、
19、(1) Si3N4 SiCl4 (2) Si3N4+3O2=3SiO2+2N2 (3) +4 -3 原子晶体
20、 ⑴ NaI NaClO
⑵ 2I-+ClO-+H2O=I2+Cl-+2OH— I2+5ClO-+2OH_=2IO3-+5Cl-+H2O
⑶ Cl2+2NaOH=NaClO+NaCl+H2O
21.(10分)
⑴△H>0(1分),升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应(2分)
⑵①降低反应所需温度,节约能源(1分)
②防止Mg被空气氧化(1分)
⑶A(1分)
![]()
说明:产物为SiO2+2MgO得0分。
![]()
说明:产物为SiO2+2CaO得1分,为CaO+CaSiO3得2分。
|
五、
22.(10分,每空2分)
(1)A:CH3—CH—CH2OH J: (2)③ ④
![]()
![]() (3)CH3—CH—CHO+2Cu(OH)2 CH3—CH—COOH+Cu2O+2H2O
(3)CH3—CH—CHO+2Cu(OH)2 CH3—CH—COOH+Cu2O+2H2O
![]() (4)[ O—CH—C ]n
(4)[ O—CH—C ]n
|
23.(10分)⑴加成反应(或加成)(2分)⑵甲醇(2分)
⑶能、分子链中有许多亲水基(-OH)(每空1分)
⑷(2分)
![]()
![]()
⑸ (2分)
![]()
六、
24。(1)〖提示〗:M1+ M2=![]() M1+
M1+![]() M2,解得
M2,解得![]() =0.60(4分)
=0.60(4分)
(2)【答:增大】(2分)
25、⑴5CO
+ I2O5![]() 5CO2+I2
5CO2+I2
⑵ 3.85mg/m3 ,符合一、二级标准