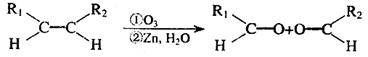高三化学第二轮复习训练题三
姓名 得分
可能用到的相对原子质量:C-12 H-1 0-16 N-14 Cu-64 Na-23 Fe-56 S-32
一、选择题共48分
6.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
|
A.Cu2S在反应中既是氧化剂,又是还原剂
B.该反应的氧化剂只有Cu2O
C.Cu既是氧化产物又是还原产物
D.每生成19.2gCu,反应中转移0.6mol电子
8.
|
A盐酸 B水 C饱和食盐水 D水
9.某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是 ( )
A.Na+、NO![]() 、Cl-、SO
、Cl-、SO![]() B.Na+、K+、Ba+、HCO
B.Na+、K+、Ba+、HCO![]()
C.Fe3+、H+、SO![]() 、Cl- D.Na+、K+、Cl-、SO
、Cl- D.Na+、K+、Cl-、SO![]()
10.X、Y均为短周期元素,且X为IA族元素,Y为VIA族元素。下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C.X2Y既可能是离子化合物,也可能是共价化合物
D.由X、Y组成的化合物中,X、Y的原子个数比不可能是1:1
|
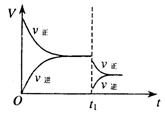
|
刻突然变化的条件可能是( )
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
12. 3.1,4—二氧六环是一种常见的溶剂,它可以通过下列方法合成,则烃A为 ( )
 CH2—CH2
CH2—CH2
A B C O O
CH2—CH2
A.1—丙烯 B.1,3—丁二烯 C.乙炔 D.乙烯
13.下列实验操作正确的是 ( )
A.配制100g 10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中
B.配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先放入烧杯中,然后加
水稀释
C.测定硫酸铜晶体中结晶水含量时,须用小火缓慢加热,同时用玻璃棒轻轻搅拌晶体,
防止晶体飞溅
D.将浓H2SO4和乙醇按体积比3:1混合,置于圆底烧瓶中缓慢加热,以制取乙烯
二、填空题共60分
26.(14分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。常温下,A、B、C、D为气体。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②D+H2O→C+E
请回答下列问题:
(1)元素Y在元素周期表中的位置为 ;A分子的空间构型是 ;B分子的电子式为 。
(2)由B气体反应生成1molA气体时放出的热量为46.2kJ,写出该反应的热化学方程式
。
(3)D的相对分子质量的理论值总是小于实验测定值的原因是 。
|
27.(12分)已知:
(1)该反应的生成物中含有的官能团的名称是 ,该物质在一定条件下能发生 ①银镜反应 ②酯化反应 ③还原反应 (填序号)
|
①—CH3 ② ③—CH=CH2
|
结构分析表明E分子中含有两个甲基且没有支链。
①写出下列转化的反应类型:
A→B ;D→E 。
②A、E的结构简式分别为 、 。
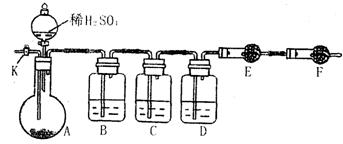
28.(18分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
|
(1)将仪器连接好以后,必须进行的第一步操作是 。(1分)
(2)此实验还须用到的最重要仪器是 ,仪器F的作用是 (3分)
(3)已知C中装有品红溶液,其作用是 ,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是 。(各2分)(4)实验室备有以下试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h. 五氧二磷 i.无水氯化钙,将下列容器中应盛放的试剂序号填入相应空格:B中 ,D中 ,E中 (各1分)
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是 。所通空气应先经过 试剂(此空1分,填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值 (填“偏高”、“偏低”或“没影响”)(5分)
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为 。(2分)
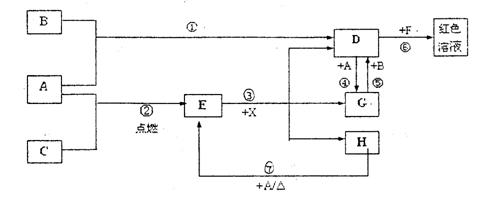
29.(16分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为红棕色液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
|
(1)写出下列物质的化学式:D ;X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;
该反应中每消耗0.3mol的A,可转移电子 mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为 。
答案
一、选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | A | C | D | C | C | D | C |
二、填空题
26.(1)第二周期VA族:三角锥形:
![]() (2)N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ·mol-
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ·mol-
![]() (3)NO2气体中存在化学平衡2NO2 N2O4,实验测定的是NO2与N2O4混合气体的平均相对分子质量。
(3)NO2气体中存在化学平衡2NO2 N2O4,实验测定的是NO2与N2O4混合气体的平均相对分子质量。
(4)8NH3+3Cl2=N2+6NH4Cl; =[(3×71+8×17)/11]/1×28==1.13
27.(1)醛基;①③
(2)②③
![]()
![]() (3)①消去反应;酯化反应
(3)①消去反应;酯化反应
![]()
② —Cl ;CH3—C—O—(CH2)6—O—C—CH3
28.(1)检查装置的气密性
(2)托盘天平:防止空气中的水蒸气及二氧化碳等进入E中
(3)检验SO2是否除尽;CO2可溶于水
(4)c;a;g;使ABCD各仪器中残留的CO2进入E被充分吸收:e或g;偏低
(5)1:1
![]() 29.(1)FeBr3 ;HBr (2)③⑥
(3)Fe3++3SCN- Fe(SCN)3;
29.(1)FeBr3 ;HBr (2)③⑥
(3)Fe3++3SCN- Fe(SCN)3;
|
(5)3Fe+4H2O(g) Fe3O4+4H2↑ 0.8
(6)Fe3++3HCO![]() == Fe(OH)3↓+3CO3↑
== Fe(OH)3↓+3CO3↑