高三化学第二轮复习训练题二
姓名 得分
可能用到的相对原子质量:C-12 H-1 0-16 N-14 Cu-64 Cl-35.5
一、填空题共48分
6.下列有关化学实验问题的叙述合理的是 ( )
A.实验室规定:所有实验剩余的药品均应放回原药品瓶内
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.用灼热的铜丝网除去N2中混有少量O2
D.用燃烧的方法除去O2中混有少量H2
7.设NA表示阿伏加德罗常数,下列说 法中正确的是 ( )
A.273℃、1.01×105Pa下,NA个SO3分子所占体积约为22.4L
B.2.3g金属钠变成离子时失去的电子数目为0.2NA
C.1L 1mol·L-1的氯化铵溶液中,NH4+数目为NA
| |
8.下列各组物质相互反应时,能产生可燃性气体的是 ( )
①炭块投入热的浓硝酸中 ②铜丝投入浓硝酸中
③过氧化钠投入水中 ④金属钠投入乙醇中
A.①③ B.②③④ C.只有④ D.②④
9.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加(过量)Mg(NO3)2溶液 ②过滤
③滴加AgNO3溶液 ④滴加(过量)Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
![]() 10.某化学反应达到化学平衡:A(气)+3B(气) 2C(气)正反应放出热量,将气体混和物的温度降低,下列叙述中正确的是 ( )
10.某化学反应达到化学平衡:A(气)+3B(气) 2C(气)正反应放出热量,将气体混和物的温度降低,下列叙述中正确的是 ( )
A.正反应速率和逆反应速率都变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反方向移动
C.正反应速率加大,逆反应速率变小,平衡向正反方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向
11.下列有关叙述正确的是 ( )
A.0.1mol·L-1的Na2CO3溶液中离子浓度关系:C(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol·L-1的NH4Cl溶液中离子浓度关系:C(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,
| |
D.在NaHCO3溶液中离子浓度关系:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
12.某阴离子RO3-所含电子数比硝酸根离子NO3-的电子数多10,则下列说法正确的是( )
①R和N不是同周期元素,也不是同主族元素
②RO3-中R元素与NO3-中N元素的化合价相同
③RO3-与NO3-只可能被还原,不可能被氧化
④R原子的电子层数比N原子的电子层数多1
A.①③④ B.①②④ C.①②③ D.③④
13.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳一碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应。把C6H5CH2CH====CH2与CH2====M在一定条件下混合反应,下列产物不可能存在的是 ( )
A.C6H5CH2CH====M B.CH2===CH2
C.C6H5CH2====CH2C6H5 D.C6H5CH2CH====CHCH2C6H5
二、填空题
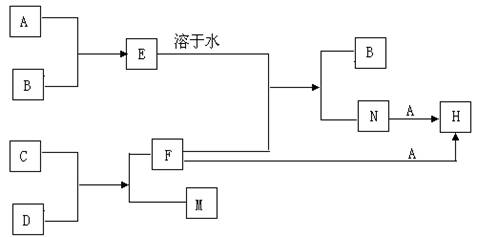
26.(18分)A、B、C、F是中学化学常见的单质,在相同条件下,气体A的密度大于气体B的密度,D为红色固体,其有关转化如下:
|
(1)写出有关反应的离子方程式:
E的水溶液+F: 。
A+N: 。
M对应的氢氧化物与氢氧化钠溶液反应:
C+D:(写出化学方程式)
(2)在足量的稀N溶液中,加入少量A的水溶液,振荡后溶液变为黄绿色。甲同学认为这不是发生化学反应所致,是A水溶液的颜色;乙同学认为是发生化学反应所致,使溶液变黄绿色的物质是生成物和A水溶液的混合颜色。
①请你判断哪位同学的推断是正确的? (填“甲”或“乙”)。
②请你设计一个实验探究你的判断;(要求写出化学实验必要的操作步骤;所用化
学试剂及实验现象;以及得出的化学实验结论)。
27.I(8分)将等物质的量为A、B、C、D四种物质混合,发生如下反应:
![]() aA+bB
cC(固)+dD当反应进行一段时间后,测得A减少了n/2mol,B减少了n mol,
aA+bB
cC(固)+dD当反应进行一段时间后,测得A减少了n/2mol,B减少了n mol,
C增加了n mol,D增加了3n/2mol,此时达到化学平衡。
(1)该化学方程式中,各物质的系数分别为:
A. ; B. ; C. ;D. 。
(2)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应的正反应为 反应(填“放热”或“吸热”)。其原因是
。
II(10分)常温下,电解200mL物质的量浓度都是0.2mol/LNaCl与CuSO4混合溶液,理论上阴极收集到气体的体积为896mL(气体体积已换算成标准状况下的体积),试回答:
(1)写出阴极、阳极两极的电极反应式:
(2)阳极收集到气体的体积为 mL(写出简要过程)
28.(14分) 莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸
是A的一种异构体。A的结构简式如下:
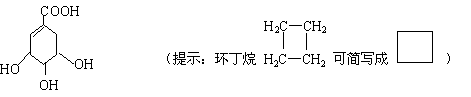
(1)A的分子式是 。
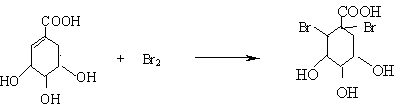
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是
;
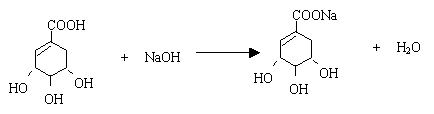
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
;
(4)17.4克A与足量碳酸氢钠溶液反应,则生成二氧化碳的体积(标准状况)为
L。
![]()
(5)A在浓硫酸作用下加热可得到B(B的结构简式为 ),
其反应类型 。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种
同分异构体的结构简式 。
29.(10分)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表:
| 实验方案 | 实验现象 |
| 1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 | (A) |
| 2.向新制的氢硫酸饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞的试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| 4.镁带与2mol/L的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| 5.铝条与2mol/L的盐酸反应 | (E)生成白色胶状沉淀,然后沉淀消失 |
| 6.向氢化铝溶液中滴加氢氧化钠溶液至过量 | (F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器: 试管夹、镊子、小刀、玻璃片、砂纸等
(3)实验内容:
与实验方案1—6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
(4)实验结论 。
答案
一、 选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | D | C | B | A | C | B | C |
二、填空题
![]() 26.(18分)(1)Fe+2H+===Fe2++H2↑
2Fe2++Cl2====2Fe3++2Cl-
26.(18分)(1)Fe+2H+===Fe2++H2↑
2Fe2++Cl2====2Fe3++2Cl-
Al(OH)3+OH-===AlO2-+2H2O 2Al+Fe2O3 Al2O3+2Fe(各3分)
(2)乙(2分)取少量的稀N溶液加入试管中,向试管中滴加KSCN溶液,没有变化,再滴加A的溶液,试管中混合液变血红色、溶液中的Fe2+被氧化生成Fe3+,Fe3+与SCN-结合生成血红色物质。(4分)(注:其它正确答案参照给分)
27.I (1)1 2 2 3 (3分)
(2)放热反应(3分),原因是升高温度化学平衡向吸热方向移动,依题意该平衡向逆向移动,所以,正方向是放热方应。(3分)
II (1) 阴极:Cu2++2e-=Cu 2H++2e-=H2↑
阳极:2Cl--2e-=Cl2↑ 4OH--4e-=2H2O+O2↑(各1分)
(2)阴极收集的气体是氢气n=0.04mol(1分)
n(Cu2+)=0.04mol(1分) n(Cl2)=0.02mol 依据得失电子守恒得出:(2分)
n(O2)=0.03mol(1分) V=672mL(1分)
28. 每空2分
(1)C7H10O5
(2)
(3)
(4) 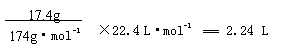
(5)消去反应
(6)3
 或
或 或
或 
26.每空2分
(1)探究同周期元素的金属性和非金属性的递变规律
(2)试管;酒精灯;胶头滴管
(3)B、F、A、D、C、E
钠浮在水面上,熔化化成小球,四处浮动,最终消失,溶液变红
(4)同周期元素从左到右金属性减弱,非金属性增强