高三化学第二轮复习训练题五
姓名 得分
可能用到的相对原子质量:C-12 H-1 0-16 N-14 Cu-64 Na-23 Fe-56 S-32
一、选择题共48分
6.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证。你认为下列做法与之不相符的是 ( )
A.推广使用乙醇汽油作汽车燃料
B.研制开发以水代替有机溶剂的化工涂料
C.农村大力发展沼气,将废弃的秸秆转化为清洁高效的能源
D.包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材使用
7.根据下列事实,对离子氧化性强弱顺序判断正确的是( )
①A+B2+=A2++B
②D+2H2O=D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+
A.E2+>B2+>A2+>D2+ B.D2+>E2+>A2+>B2+
C.D2+>A2+>B2+>E2+ D.A2+>B2+>D2+>E2+
8.在5L密闭容器中,1molA和3molB在一定条件下反应:
![]() A(g)+mB(g) 2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是( )
A(g)+mB(g) 2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是( )
A.m值等于3
B.A的转化率为40%
C.平衡时,体系中c(A):c(B):c(C)=4:9:8
D.用B表示该反应的平均反应速率为0.08mol·L-1·min-1
9.在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
10.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,如果出现沉淀则过滤,再将滤液与第三种溶液混合起来,最终所得的溶液 ( )
A.一定呈酸性 B.一定呈碱性 C.可能呈中性 D.一定呈中性
11.下列各组离子在溶液中能大量共存,并且加入过量NaOH溶液得到澄清溶液的是( )
A.Fe3+、Na+、I-、SO42- B.Al3+、Na+、Cl-、NO3-
C.Ag+、Na+、Cl-、NO3- D.K+、Al3+、AlO2-、CO32-
| |
A.d<c<a<b B.c<d<b<a C.d<a<b<c D.c<d<a<b
13.6.4g铜跟60mL8mol·L-1的硝酸充分反应,硝酸的还原产物有NO、NO2。铜完全溶解后,测得溶液中H+的物质的量为nmol,此时溶液中所含NO3-的物质的量为 ( )
A.(n + 0.2)mol B.(n + 0.4)mol C.0.28mol D.0.31mol
二、填空题
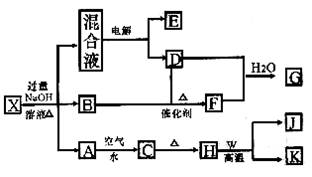
26.(12分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
|
请回答下列问题:
(1)B气体的检验方法为 。
(2)电解混合液时能产生O2的阳极反应式为 。
(3)按要求写出上述转化关系中有关反应的化学方程式:
①含有K元素的化合反应 。
②含有K元素的转换反应 。
(4)K与过量G的稀溶液反应的离子方程式为 。
(5)物质X的化学式为 。
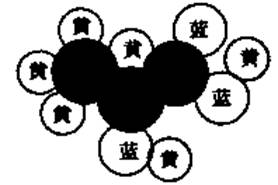
27.I(8分)在化学上常用的两种模型来表示分子结构,一种是球棍模型,另一种是比例模型。比例模型是用不同颜色球的体积比来表示分了中各种原子的体积。
|
A.饱和一元醇 B.饱和一元醛
C.二元酸 D.羟基酸
(2)该物质可发生的反应有( )
A.与H2加成 B.银镜反应
C.消去反应 D.与乙醇酯化
(3)根据(2)中选择,写出该物质发生反应的化学方程式。
II.(12分)实验测得A、B、C三种有机物的相对分子质量均为72。
(1)已知A中只含C、H两种元素,且质量比为5:1,则其分子式为
在它的同分异构体中,沸点最高的是 (写结构简式);一氯化物只有一种的是 (写名称)
(2)已知B是烃的含氧衍生物,分子中只有一个官能团,且能发生银镜反应。请写出B可能的结构简式
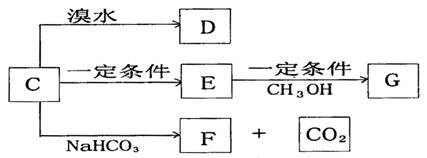
(3)C能发生如下变化
|
已知E和G都是高分子化合物,其中G是一种重要的有机合成材料。请按要求填空:
①C的结构简式为
②E→G的化学方程式为
|
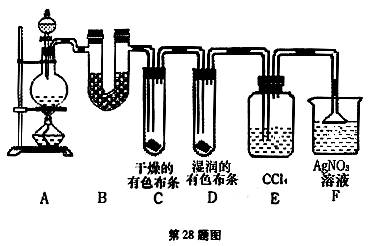
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热;
③次氯酸钠和浓盐酸混合; ④K2Cr2O7和浓盐酸混合;
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。
29.(10分)短周期元素A、B、C、D、E的原子序数依次增大,B与A能形成原子个数比分别为:1:1、1:2、1:3、1:4等多种共价化合物,D原子L层电子数比C原子L层电子数多2,C原子核外电子总数比D原子少3,E原子最外层电子数比次外层电子数少2。
(1)D与E形成的化合物的水溶液呈 (填“酸”或“碱”或“中”)。
(2)A与C形成的原子个数比为1:1的化合物的电子式是 。
(3)B与A形成的原子个数比为1:1的某种常见化合物,在常温下为气态。写出实验室制取该物质的化学方程式 。
(4)都由A、C、D、E四种元素组成的两种化合物的水溶液能相互发生化学反应,写出反应的离子方程式 。
(5)写出我国在工业上制备EC2反应的化学方程式 。
答案
一、 选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | A | C | B | C | B | A | A |
二、填空题
26.(1)使湿润的红色石蕊试纸变蓝(其它合理答案均可)
|
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe2O3+4Al 2Fe+Al2O3
(4)Fe+4H++NO![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
(5)(NH4)2Fe(SO4)2
27. (1)D (2)CD
(1)D (2)CD
 (3)CH3CH(OH)COOH
CH3=CHCOOH+H2O
(3)CH3CH(OH)COOH
CH3=CHCOOH+H2O
CH3CH(OH)COOH+CH3CH2OH CH3CH(OH)COOCH2CH3+H2O
(1)C5H12 CH3CH2CH2CH2CH3, 新戊烷或2,2,—二甲基丙烷
(2)CH3CH2CH2CHO,(CH3)2CHCHO
(3)①CH2 = CHCOH
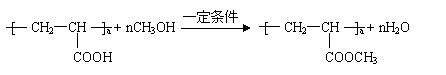 |
②
28.(1)D
(2)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失
(3)①证明有水蒸气产生 白色变蓝色(其它合理答案也给分)
②氯气无漂白性,次氯酸有漂白性 ③吸收氯气 ④Ag-+Cl-=AgCl↓
(4)E F 湿润的淀粉KI试纸(或湿润的有色布条)
29.(1)碱 (2) H:O:O:H
(3)CaC2+2H2O→Ca(OH)2+C2H2↑
|
(5)4FeS2+HO2 2Fe2O3+8SO2