高三化学第二轮复习训练题四
姓名 得分
可能用到的相对原子质量:C-12 H-1 0-16 N-14 Cu-64 Na-23 Fe-56 S-32
一、选择题共48分
6.通过复习总结,你认为下列对化学知识概括合理的是 ( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
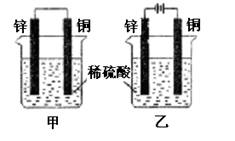
|
浓度的稀H2SO4中一段时间,以下叙述正
确的是
A.两烧杯中铜片上均有气泡产生
|
| |
D.甲中的锌比乙中的锌腐蚀慢
8.某溶液中有①Ba2+ ②NH4+ ③Mg2+ ④Fe2+ ⑤A13+等离子,若向其中加入过量的NaOH
溶液,微热并搅拦,再加入过量盐酸,溶液中大量减少的阳离子有 ( )
A.①② B.②④ C.仅② D.②④⑤
9.下列离子方程式中正确的是 ( )
A.NH4HSO4溶液中加入足量的Ba(OH)2溶液
H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.Ca(C1O)2溶液中通入过量的CO2气体:
Ca2++2C1O-+CO2+H2O=CaCO3↓+2HC1O
D.NaA1O2溶液中加入过量盐酸:A1O2‑+4H+=A13++2H2O
10.已知某400mL FeCl2溶液中含溶质0.25mol,向其中通入2.24L(标准状况下)的Cl2,充分反应后溶液中的Fe3+的物质的量浓度为(假设反应前后溶液体积不变) ( )
A. 0.5mol/L B.0.625mol/L C.0.25mol/L D.0.125mol/L
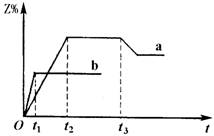
![]()
|
含量随时间t变化的a,b两条曲线(如图所示)。
已知在t3时刻改变了某一实验条件,相关判断正
确的是 ( )
A.曲线a是500℃时的图像
B.正反应是吸热反应
C.t3时刻可能是增大了压强 D.t3时刻可能是降低了温度
12.下列除去括号内杂质的有关操作方法不正确的是 ( )
①苯(苯酚):加入NaOH溶液,分液
②乙醇(乙酸):加KOH溶液,分液
③苯(甲苯):加KMnO4/NaOH溶液,蒸馏
| |
⑤乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
⑥淀粉溶液(葡萄糖):渗析
⑦提取溶解在水中的少量碘;加入CCl4,分液,取出有机层再分离
|
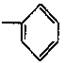
13.由—CH3、—OH、 、—COOH四种基团,两两组合而成的化合物中,其中能与钠反应的是( )
A.3种 B.4种 C.5种 D.6种
二、填空题
26.(10分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的名称
A. B. C.
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为:
(3)已知DB2在一定条件下可转化为DB3,1mol DB2充分反应,放出98.3kJ的热量。该反应的热化学方程式是 ,工业上进行这一反应的设备是
反应的适宜条件为 。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为:
;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是: 。若改用铁棒做阳极材料,则阳极的电极反应式为: 。
27.(12分) 有机物参加的反应往往比较复杂,常有副反应发生。乙烯跟溴水反应既可生成A,同时又生成C2H5Br和B。已知G由碳、氢、氧三种元素组成,且质量比为 m(C)∶m(H)∶m(O) = 6∶1∶12 ,H为高分子化合物,I为六元环状化合物。
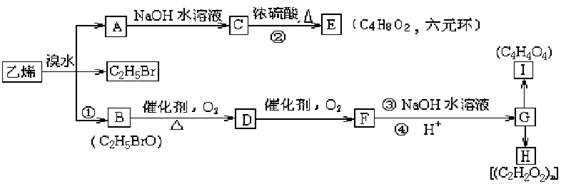 根据上述信息,请回答下列问题:
根据上述信息,请回答下列问题:
(1)G的分子式为 。
(2)写出下列物质的结构简式。
A ,B ,I 。
(3)指出反应类型。
反应①为 ,反应②为 。
(4)写出D发生银镜反应的化学方程式
28.I(9分)贮气袋中贮有有色气体,可能由NO2、CH4、CO2、HCl、NH3、Br2(蒸气)等气体中的几种混合而成。现分别进行如下实验:
①通入少许水中,得无色溶液;
②通入少许AgNO3溶液中,有沉淀析出;
③通入少许澄清石灰水中,无浑浊现象;
④通过盛水的洗气瓶后,导出的气体再通入澄清的石灰水,石灰水变浑浊。试回答
(1)由①可判断一定存在 ,一定不存在 ;
(2)由②可判断一定存在 ,一定不存在 ;
(3)由③④可判断一定存在 ,可能存在 ;
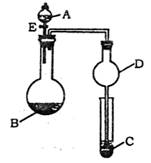
|
(1)若A为水,B为电石,C盛有酸性高锰酸钾溶液,
旋开E后,C中的现象为 ;
A与B反应的化学方程式为 。
(2)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,
旋开E,往C中通入气体足够长的时间后,C中的
现象是 ,C中发生反应的离子方程式
为 。此实验中D装置的
作用 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是
;继续通气体于C中,足够长时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式
。
(4)该题图示装置有多种用途,请举一例(除题中之外)填空;
A为 ,B为 ;C中盛有 ,其目的为 。
29.(9分)A、B、C、D、E为短周期的五种元素,它们原子序数依次递增,B是构成有机物的主要元素;A与C可形成10电子化合物W,它可使紫色石蕊试液变蓝;D元素的原子最外层电子数是其次外层电子数3倍;E是同周期元素中原子半径最大的元素;A、B、C、D可形成化合物X,在X晶体中阳离子与阴离子个数比为1:1;A、D、E可形成化合物Y。A、C、D可形成离子化合物Z。
回答下列问题:
(1)Y的电子式: ;W的空间构型: ;
(2)写出Z的水溶液中各离子浓度由大到小的顺序: ;
(3)写出常温下X与足量的Y在溶液中反应的离子方程式:
;
答案
一、 选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | C | B | D | A | C | A | C |
二、填空题
26.(10分)每空1分
|
![]() (3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
(3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
接触室:400-500℃,催化剂;
(4)使湿润的淀粉碘化钾试纸变蓝:Cl2+2OH—=ClO—+Cl—+H2O;Fe-2e—=Fe2+
O
27.(1)C2H4O3 (2)A:BrCH2CH2Br B:BrCH2CH2OH I:CH2—C—O
O—C—CH2
O
(3)加成 取代
(4)BrCH2CHO+2Ag(NH3)2OH→BrCH2COOH+H2O+Ag+3NH3
28.I(1)NO2,Br2; (2)HCl,NH3; (3)CO2,CH4 (每个空1.5分)
II(1)紫色KMnO4 溶液褪色
CaC2 + 2H2O →C2H2↑+Ca (OH)2
(2)生成白色沉淀
![]() Al3+
+ 3NH3·H2O Al (OH)3↓+3NH4+ 防止倒吸
Al3+
+ 3NH3·H2O Al (OH)3↓+3NH4+ 防止倒吸
(3)溶液变蓝;
![]() I2
+ 5Cl2 + 6H2O 2HIO3 +
10HCl
I2
+ 5Cl2 + 6H2O 2HIO3 +
10HCl
(4)HCl,Na2CO3;澄清石灰水,检验CO2(填其它答案,只要合理均给分)
29.(9分)(1)Na+[ O H]— 三角锥形
(2)C(NO3—)>C(NH4+)>C(H+)>C(OH—)
(3)NH4++HCO3—+2OH— NH3·H2O+CO32—+H2O(3分)