高三化学第四次统考试题
命题:黄重武
可能用到的相对原了质量:
H-1 O-16 S-32 Al-27 Fe-56 Cu-64 Zn-65 Ag-108 Br-80 C-12
第Ⅰ卷(选择题,共54分)
一、选择题(包括18小题,每小题3分;每小题只有一个选项符合题意)
1.下列说法正确的是
A.二氧化硫的水溶液能导电,二氧化硫是电解质
B.弱电解质加水稀释,电离程度一定增大,离子浓度可能增大
C.电解质一定能导电,强电解质导电能力一定强
D.熔融的电解质一定能导电
2.下列各组溶液,只用试管和胶头滴管,不用任何试剂便可以鉴别的是
A.![]() B.
B.![]()
C.![]() HCl D.
HCl D.![]()
3.有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26g与足量稀硫酸反应在标准状况下产生H2 11.2L,此混合物的可能组合为
A.5种 B.4种 C.3种 D.2种
4.C2H4和C2H2混合物1.00L在氧气中充分燃烧,生成2.0LCO2和1.4L水蒸气则原混合气中C2H4和C2H2的体积比是
A.1:3 B.2:3 C.3:1 D.3:2
5.相同温度相同浓度下列盐溶液:①NaHSO4 ②FeCl3 ③KNO3 ④NaAlO2 ⑤Na2CO3 ⑥CH3COONa溶液按PH由大到小的顺序排列,正确的是
A.①②③④⑤⑥ B.④⑤⑥③②① C.④⑥⑤③②① D.④⑤③①②⑥
6.蒸发下列物质的溶液并灼烧,能得到纯净该物质的是
A.NaHCO3 B.Mg(NO3)2 C.K2SO4 D.NH4Cl
7.下列反应的离子方程式不正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.醋酸与苛性钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
C.澄清石灰水与少量苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.KAl(SO4)2溶液与Ba(OH)2溶液反应,硫酸银离子全部沉淀
析出:Al3++4OH-+Ba2++SO42-=BaSO4↓+AlO2-+2H2O
![]() 8.以苯乙炔: 为基本原料,经过反应可以得到一系列的芳烃一芳炔大环化合物。下列关于某种芳炔大环化合物不正确的是
8.以苯乙炔: 为基本原料,经过反应可以得到一系列的芳烃一芳炔大环化合物。下列关于某种芳炔大环化合物不正确的是
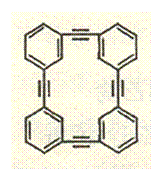 A.该化合物的一氯代物只有三种
A.该化合物的一氯代物只有三种
B.1mo1该化合物分子最多可以与20m01H2发生加成反应
C.该化合物的分子式为C32H16
D.该化合物中碳氢两元素质量比为24:1
9.一定量的盐酸跟随过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的:
①CaCO3(固) ②Na2SO4溶液 ③CH3COONa(固)
④KNO3溶液 ⑤CuSO4(固) ⑥加水`0
![]()

![]() A.②③⑥ B.①④⑤ C.②③④ D.②④⑥
A.②③⑥ B.①④⑤ C.②③④ D.②④⑥
![]() 10.
都属于萘( )
10.
都属于萘( )
、 、
的同系物萘和萘的同系物分子组成通式为
A.CnH2n-12(n![]() 10) B.CnH2n-6(n
10) B.CnH2n-6(n![]() 11)
11)
C.CnH2n-8(n![]() 10) D.CnH2n-10(n
10) D.CnH2n-10(n![]() 10)
10)
11.下列实验操作和叙述正确的是
A.蒸馏时,温度计水银球应插入液面下,蒸馏烧瓶中应加入少许瓷片
B.除去混在CH4中的少量C2H4、H2O(g),先用酸性KMnO4溶液洗气,再用
碱石灰干燥
C.降去混在Cl2中的HCl,用饱和食盐水,降去CO2中的HCl,用饱和Na2CO3溶液
D.中和滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分仍有气泡,则测得的待测液浓度偏低
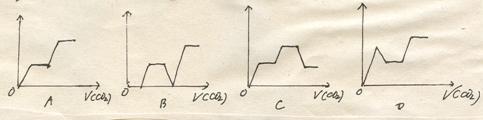
12.将足量的CO2不断通入NaOH、Ba(OH)2、KAlO2的混合溶液中,生成的沉淀与通入的CO2的量的关系可表示为
|
13.下列各组离子在特定环境中可能大量共存的一组是
A.在滴加酚酞试液呈红色的溶液中:K+、AlO2-、HCO3-、Na+、I-
B.在加入铝粉产生氢气的溶液中:Al3+、NH4+、Fe3+、Cl-、Br-
C.在无色且存在SO42-的溶液中:Cu2+、MnO4-、Mg2+、Ag+、NO3-
D.在PH=0的溶液中:SO32-、NO3-、Mg2+、Na+、Fe2+
|
![]() 14.有烃:
C-C=CH-CH2-CH3该分子中含有四面体结构的碳原子数为a,在同一直线上碳原子最多为b,一定共同一平面的原子为C,则a、b、c分别为
14.有烃:
C-C=CH-CH2-CH3该分子中含有四面体结构的碳原子数为a,在同一直线上碳原子最多为b,一定共同一平面的原子为C,则a、b、c分别为
A.4,4,8 B.4,5,10 C.4,6,9 D.5,4,12
15.在NaHS溶液中存在多种分子和离子,下列关系中不正确的是
A.C(Na )+ C(H )=C(OH )+C(HS )+2C(S )
B.C(Na )=C(HS )+C(S )+C(H S)
C.C(H )+C(H S)=C(OH )+C(S )
D.C(OH )+C(HS )=C(H )+C(H S)
16.下列事实不能说明醋酸是弱电解质的是
①醋酸易溶于水 ②醋酸溶液中存在醋酸分子 ③0.1m/L的醋酸的PH比0.1m/L的盐酸PH大 ④醋酸与碳酸钙反应放出CO2 ⑤0.1m/L的醋酸钠溶液的PH=8.9 ⑥PH相同的醋酸、盐酸稀释同等的倍数,醋酸的PH较小 ⑦醋酸溶液能导电⑧PH相等,体积相等的盐酸和醋酸,与等浓度的NaOH溶液充分反应,醋酸消耗的碱多
A.②③④⑧ B.④⑤⑥⑦ C.②③⑤⑥⑧ D.①④⑦
17.据最新报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5(LaNi5H6中各元素化合价均为零),电池反应通常表示为:
 LaNi5H6+6NiO(OH)
LaNi5+6Ni(OH)2,下列说法不正确的是
LaNi5H6+6NiO(OH)
LaNi5+6Ni(OH)2,下列说法不正确的是
A.放电时,LaNi5H6为负极
B.放电时的正极反应为:6NiO(OH)+6e-+6H2O→6Ni(OH)2+6OH-
C.充电时,储氢合金作阴极
D.充电时,阳极周围溶液的PH升高
18.一种气态烷烃和一种气态烯烃组成的混合气共10g,混合气的密度是标准状况下H2的密度的12.5倍,让混合气通过盛有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,则组成的混合气体可能是
A.乙烷和乙烯 B.甲烷和乙烯 C.乙烯和丙烯 D.甲烷和丙烯
第Ⅱ卷 (非选择题 共54分)
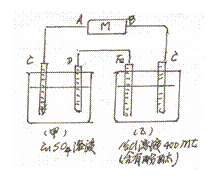 19.(10分)下图所示相互串联的甲、乙两电解池,若已知电解一段时间后Fe周围溶液变红色,则:
19.(10分)下图所示相互串联的甲、乙两电解池,若已知电解一段时间后Fe周围溶液变红色,则:
(1)电极名称:Fe为__________极电源M中B为_____极;甲池中阴离子定向往_____极移动(填字母C或D)
(2)若甲池为电镀池,要在Zn上镀Cu,则D极材料为__________,电极反应为 _____________________;
(3)若甲池中Zn片增重12.8g时,则乙槽中____极放出_________L____气(标况下);
(4)Zn片上镀了12.8gCu时,乙池溶液的PH为________(假定溶液总体积不变)。
20.(12分)回答下列各问题:
(1)当0.2mol烃A在氧气中完全燃烧生成CO2和H2O各1.2mol,催化加成后生成2,2一二甲基丁烷,则A的结构筒式为_________________,A在一定条件下与H2加成,得到的产物与Cl2反应,生成的一氯取代物有__________种;
(2)某炔烃和H2充分加成生成2,5一二甲基已烷,该炔烃结构筒式:______________________________________;
(3)某气态烃100mL(标态下)与含1.43g的溴的溴水恰好完全加成,生成物经测定每一个碳原子上各有一个溴原子,则该烃结构简式____________,写出该烃在一定条件下发生加聚反应的化学方程式:________________________________________________;
(4)某烃1mol与2mol氯化氢完全加成,生成的氯化烃最多还可以与4molCl2反应,则该烃的结构式是________________________________.
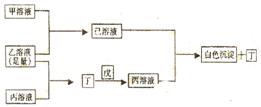
|
请回答:
(1)写出C元素的原子结构示意图__________戊中阴、阳离子比为_________;丁的电子式___________。
(2)甲溶液呈现碱性的原因(用离子方程式表示)________________________;
(3)写出有关的反应离子的离子方程式
①甲溶液+乙溶液(足量)→已溶液:_________________________________;
②丙溶液+已溶液→白色沉淀+丁:____________________________________;
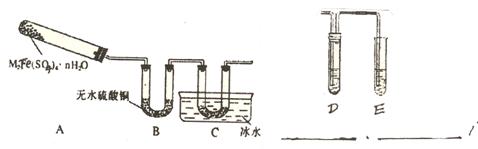
22.(12分)某研究性学习小组的同学对2M2Fe(SO4)4•nH2O受热分解的情况进行探究。
(1)资料表面,在加热条件下三氧化硫具有比较强的氧化性。甲同学认为:
2M2Fe(SO4)4•nH2O受热分解的产物是2M2O3、FeO、SO3、H2O。你支持甲同学的观点吗?________(填写“支持”或“不支持”)说明你的理由 _____________
_______________________________________________________。
(2)乙同学用如下装置通过实验来探究2M2Fe(SO4)4•nH2O受热分解的产生情况(加热及夹持装置未画出):
|
实验过程中发现:装置A中残留固体为金属氧化物,其中金属元素的化合价相同,装置B中无水硫酸铜变蓝,并增重7.2g,装置C中的U型管中有无色晶体出现,且有刺激性气体逸出。
回答下列问题:
①装置A中残留的固体可全部溶于盐酸但只能部分溶于NaOH溶液(足量),未溶解的固体质量为1.6g,则M可能是________(用元素符号表示),n=__________。
②装置C的U型管中无色晶体是____________。
③乙同学为了验证2M2Fe(SO4)4•nH2O受热分解的其它产物,在C装置后连接适当装置,并选用了合适的药品,不仅达到了实验目的而且还起到吸收尾气的作用,请你在C装置后的D、E的装置的下面注明你选用的药品。
④写出2M2Fe(SO4)4•nH2O受热分解的化学方程式:
______________________________________________________________。
23.(8分)常温下,将Xmol铁和Xmol铜投入含Ymol硝酸的热的10mL浓硝酸中,经过一段时间后,使它们恰好完全反应。已知反应后的溶液中Fe2+、Fe3+的物质的量相等,硝酸的还原产物为NO、NO2两种气体(不考虑NO2转化为N2O4)为560mL,将混合气通入水中,充分反应,气体体积减少224mL(标况下)。通过计算:
(1)![]()
(2)若反应后溶液的体积仍为10mL,原浓销酸物质的量浓度为__________。
 高三化学第四次统考试题答题卡
高三化学第四次统考试题答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
19.(1)______________ _______________
(2)______________ _________________________________
(3)______________ _______________ _______________
(4)___________________
20. (1)______________ _______________
(2)_______________________________________________
(3)______________ _______________________________________
(4)_________________________
21. (1)______________ ______________ _______________
(2)____________________
(3)①______________________________
②____________________________________________________
22.(1)_______ _________________________________________________
(2)①______________ ___________ ②___________
③
④__________________________________________________
23.(1)________________
(2)________________________________________________________