综合练习
高三化学试卷
本试卷分试卷和答题卡两部分。试题卷1至8页。共150分。考试时间120分钟。
第I卷(选择题 共64分)
可能用到的相对原子质量:
H-1 N-14 O-16 Na-23 C-12 Mg-24
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、1828年,德国化学家乌勒(F·Wohler)冲破了生命力学说的束缚,在实验室里将无机物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素(CO(NH2)2),他的这一功绩,恩格斯曾给予了很高的评价。下列说法不正确的是( )
A、氰酸铵属于铵盐 B、氰酸铵与尿素化学性质不同
C、氰酸铵转化为尿素的过程为物理变化 D、有机物不一定要从生命体内获得
2、2006年2月,中国科学家率先建成了世界上第一个全超导核聚变“人造太阳”实验装置,模拟太阳产生能量。这个装置从内到外一共由五层部件构成,最内层的环行磁容器像一个巨大的游泳圈,进入实验状态后,“游泳圈”内部将达到上亿度的高温,这也正是模拟太阳聚变反应的关键部位。“人造太阳”实验装置正是起着这一转化作用,通过磁力线的作用,氢的同位素等离子体被约束在这个“游泳圈”中运行,发生高密度的碰撞,也就是聚变反应。下列有关说法中不正确的是( )
A、“人造太阳”可为人类提供清洁的核聚变能源
B、“人造太阳”实验装置中发生的聚变反应是化学反应
C、氢的同位素氘和氚可以从海水中大量提取
D、太阳上的聚变反应是不可控的,“人造太阳”实验装置可实现受控热核聚变反应
3、已知A2On2-可与B2-反应,B2-被氧化为B单质,A2On2-被还原为A3+,若100mL 0.3mol/L的A2On2-溶液,与150mL 0.6mol/L的B2-溶液恰好完全反应,则n值为( )
A、5 B、6 C、7 D、8
4、下列实验操作或对实验事实的叙述正确的是( )
A、使用胶头滴管的任何实验都不允许将滴管插入液面以下
B、为了获得胆矾,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止
C、植物油和裂化汽油可用溴水鉴别
D、配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
5、某离子晶体中晶体结构最小的重复单元(晶胞)如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
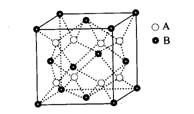
A、B2A B、BA2 C、B7A4 D、B4A7
6、和田玉在我国至少有7000年的历史,也称为软玉,是我国玉文化的主体。和田玉是具有链状结构的含水钙镁硅酸盐,某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,有关叙述正确的是( )
A、其化学式改写成氧化物表示为:2CaO·3MgO·Fe2O3·2SiO2·H2O
B、它能抵抗任何酸碱的腐蚀 C、其中Fe的化合价为+2价
D、其中Fe的化合价为+3价
7、已知氧化亚铜与稀H2SO4反应有CuSO4和Cu生成。现将一定量的氢气在加热条件下通过一定量的氧化铜,为了检验残留物质的成分,下列实验得出的结论正确的是( )
A、加入稀HNO3充分反应后溶液呈现蓝色,不能说明残留物中是否混有氧化铜
B、加入稀硫酸充分反应后溶液呈现蓝色,说明残留物中一定混有氧化亚铜
C、加入稀硫酸充分反应后有红色沉淀物,说明残留物中一定混有氧化亚铜
D、加入稀HNO3充分反应后有无色气体产生,说明残留物中一定混有单质铜
8、常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法正确的是( )
A、S8转化为S6、S4、S2属于物理变化
B、不论哪种硫分子,完全燃烧都生成SO2
C、常温条件下单质硫为原子晶体
D、把硫单质在空气中加热到750℃即得S2
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。)
9、设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、1mol金刚石晶体中含碳碳键数为2NA
B、如果5.6L N2含有n个氮分子,则NA一定约为4n
C、标准状况下,22.4L SO3中含有的氧原子数约为3NA
D、1mol Na2O2与足量CO2反应转移的电子数NA
10、下列反应的离子方程式正确的是( )
A、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B、FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
C、用氨水吸收少量的SO2:NH3 ·H2O+SO2==NH4++HSO3-
D、碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-==CO32-+H2O
11、X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A、Y元素最高价氧化物对应水化物的化学式为H2YO4
B、原子半径由小到大的顺序为:W<X<Y<Z
C、X与W可以形成W2X、W2X2两种化合物
D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
12、一定能在下列溶液中大量共存的离子组是( )
A、水电离产生的c(H+)=1×10-12mol/L溶液中:NH4+、Na+、Cl-、HCO3-
B、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C、含有大量Fe3+的溶液中:Na+、I-、K+、Br-
D、澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
13、下列叙述正确的是( )
A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若c(CH3COO-)>c(Na+),则混合液一定呈碱性
B、常温下,将等体积0.01mol/L HCl与pH=12的氨水混合,则混合液的pH=7
C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-)
D、将pH=3的HR与pH=11的NaOH等体积混合,已知pH≠7,则混合溶液的pH一定小于7
14、改革开放以来,经济实现了快速发展,各地的城市化建设也进入了和谐的人性化发展阶段,例如建设市民广场,为市民提供夏夜纳凉的好去处。夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
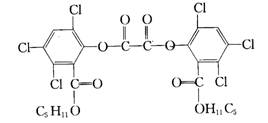
下列说法正确的是( )
A、CPPO属于芳香族化合物 B、CPPO属于高分子化合物
C、1mol CPPO与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4mol NaOH
D、1mol CPPO与氢气完全反应,需要氢气10mol
15、美国研究人员在新一期网络版《科学》杂志上发表论文说,他们开发出了一种新的固体氧化物燃料电池,在用碳氢化合物——异辛烷作燃料时能源转换效率有望达到50%,电解质是用一层以氧化锆为主、含有少量钌和铈的催化重整多孔薄膜,它在高温下能传导O2-。这种新型燃料电池在经过更多试验后,能广泛应用于汽车、飞机,甚至众多家庭。下列说法正确的是( )
A、该电池的正极反应为:O2+2H2O+4e-=4OH-
B、该电池的负极反应为:C8H18+25O2――50e-=8CO2+9H2O
C、固体电解质的作用是传递电子
D、电池中阴离子向正极移动
16、在一个1L的密闭容器中,加入2mol A和1mol B,发生下述反应:
2A(g)+B(g)==3C(g)+D(s)
达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是( )
A、1mol A+0.5mol B+1.5mol C+0.1mol D
B、3mol C+0.7molD
C、2mol A+1mol B+1molD
D、0.5mol A+0.25mol B+2.25mol C
第II卷(非选择题,共86分)
三、(本题包括2小题,共21分)
17、(11分)已知:以体积比1:1的硫酸浓度大于60%,具有一定的氧化性,浓度越大,氧化性越强,60%以下的硫酸氧化性就不怎么强。
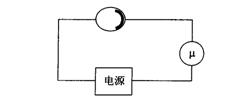
I.某兴趣小组为研究浓硫酸(98%的浓硫酸密度为18.4g/cm3)的氧化性,设计实验装置如图。认真分析后回答:
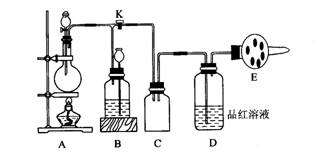
(1)装置B用来储存多余的气体。当D处有明显的现象后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中现象是:____________________________。
(2)同学甲先向烧瓶中放入铜片和3mL水,再从分液漏斗中加入10滴浓硫酸(约0.5mL),加热至沸腾,烧瓶中的液体是否有明显的变化,其原因是____________________________
______________________________________________________________________。甲同学再用分液漏斗加浓硫酸10mL,再加热到沸腾,现象是________________________________;
乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。观察到的现象与甲不同的是___________________________________________,原因是_________________________
______________________________________________________________________。
II.如用一定质量的铜片、一定体积18mol/L的浓硫酸放在烧瓶中共热后,测定剩余酸的物质的量浓度(忽略溶液体积变化),丙、丁两同学设计如下:
(3)丙先测定装置A产生SO2的量,再计算剩余酸的物质的量浓度。测定SO2的量的方法很多,其中可行的是________________
A、将装置A产生的气体通入足量硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
B、将装置A产生的气体用排水法测定体积(已折算成标况)
C、将装置A产生的气体用排饱和NaHSO3溶液法测定体积(已折算成标况)
(4)丁将反应后的溶液稀释至1L,取20mL于锥形瓶中,滴入2滴酚酞,用标准NaOH溶液滴定,通过NaOH溶液的体积求剩余酸的浓度(已知Cu(OH)2开始沉淀的pH为5)。丁的方案能否求得余酸的物质的量浓度。简述理由。___________________________________
______________________________________________________________________________。
(5)试设计一个可行的方案,简述操作步骤及需要测定的数据。
18、(10分)实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取mg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
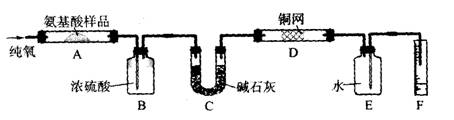
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是:______________________________
(2)以上装置中需要加热的仪器有__________(用字母填空,下同)。操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是_______________________________________。
(4)装置D的作用是________________________________________________________。
(5)读取N2的体积时,应注意:①_______________________________________________、②______________________________________________________________。
(6)实验中测得N2的体积V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________________________________________。
四、(本题包括2小题,共18分)
19、(8分)目前,世界上一些发达国家在积极研究太空太阳能电站问题。这种空间太阳能电站建在地球同步轨道的一个固定位置上,向地球上固定区域供电。其发电及传输示意图如图所示。在太阳能收集板上铺设太阳能电池,通过光电转换把太阳能转变成电能,再经微波转换器将电流转换成微波,并通过天线将电能以微波能形式向地面发送,地面接收站通过整流天线把微波能还原成电流。制造太阳能电池需要高纯度的硅,工业上由粗硅制取高纯度硅通过以下反应实现:
![]()
![]() ①Si(s)+3HCl(g)
SiHCl3(g)+H2(g);△H=-381kJ/mol
①Si(s)+3HCl(g)
SiHCl3(g)+H2(g);△H=-381kJ/mol
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
(1)元素硅在周期表中的位置位于_______________;晶体硅属于__________晶体,是_________体(导体、半导体、绝缘体);晶体硅有类似金刚石的结构,每摩尔晶体硅的共价键数目为____________,键角为________________。
(2)关于上述条件下的两个反应下列叙述不正确的是( )
A、都是置换反应 B、都是可逆反应 C、都是氧化还原反应
(3)反应②的热效应为____________反应(填“放热”或“吸热”)
20、(10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g/mol ,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系。
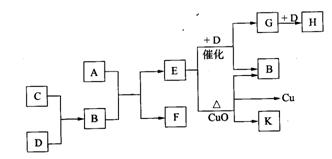
试填写下列空白:
(1)甲元素的单质在空气中燃烧除得到A外,还可得到_________。A的电子式为________。
(2)“E+D→G+B”的化学方程式为_____________________________________;
“E+CuO”的化学方程式为_________________________________________________。
(3)C和D两元素还可以形成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为__________________________________________________。
五、(本题包括1小题,共10分)
21、(10分)《2004年江苏省环境公报》指出:2004年全省废水排放总量为46.6亿吨,其中工业废水排放量为26.3亿吨,生活污水排放量为20.3亿吨。废水中化学需氧量(COD)排放总量为85.4万吨,其中工业废水中COD排放量为29.8万吨,占COD排放总量的34.9%;生活污水中COD排放量为55.6万吨,占COD排放总量的65.1%。氨氮排放总量为7.3万吨,石油类排放总量为1804.3吨,挥发酚排放总量为74.3吨。回答下列问题:
(1)江苏省水污染的特征是____________________________________________________。
(2)某校研究性学习小组拟选择“本地水污染情况分析”的课题进行探究。
水中的NO2-是含氮的有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
(I)配制标准溶液:称取0.30g NaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
![]() (II)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(
)粉末,实验结果如下表所示。
(II)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(
)粉末,实验结果如下表所示。
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
(III)检测:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。请填写以下空白:
A、比色法的基本依据是________________________________________________________。
B、若水样显色后与色阶中的5号颜色相同,则表明水样中含NO2-含量为_______mg/L。
C、用NaNO2直接配制溶液B的缺点是_________________________________________。
D、如果水样显色后比6号还深,应采取的措施是_________________________________。
六、(本题包括2小题,共19分)
22、(7分)据我国统计资料显示,中国35~74岁人群中,高血压的发病率高达约27%,患者人数已接近一亿三千万,每年新增300万以上。高血压可引发心、脑、肾等器官的损伤,严重威胁人类的健康和生命。尼群地平片可用于治疗高血压。其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用。它的主要成分的结构为下图所示:
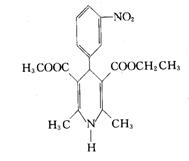
试根据结构回答下列问题。
(1)该物质的分子式为____________,____________溶于水(填“能”或“不能”)
(2)下列对该物质的描述不正确的是( )
A、在一定条件下能发生取代反应 B、能在酸性条件下发生水解反应
C、能和溴水发生加成反应 D、能发生银镜反应
(3)该物质在镍催化的条件下最多可以和_________mol氢气发生__________反应(填反应类型)。
(4)请写出尼群地平片的主要成分与足量的氢氧化钠溶液反应时的化学方程式:
23、(12分)聚丙交酯可抽丝用作外科手术缝线,在人体内可自动缓慢降解为乳酸而不须拆除。黏合剂I是一种高分子涂料,其性能优良,装饰性能好。已知:
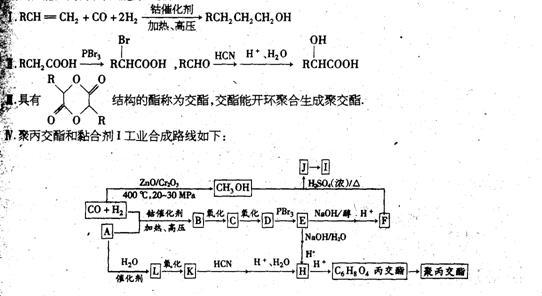 回答下列问题:
回答下列问题:
(1)A的分子式是________________,E的结构简式是______________________。
(2)由A转化为H的两条途径各自涉及到多个化学反应,但两条途径有一个共同点,这个共同点是_________________________;
(3)写出下列化学反应方程式:
J→I:____________________________________________________________________;
丙交酯→聚丙交酯:_______________________________________________________。
(4)请以丙烯为原料,利用必要的无机试剂和反应条件,合成化合物H:
提示:① 合成过程中无机试剂任选;② 如有需要,可以利用试卷中出现过的信息;③ 合成反应流程示意图表示方法如下:
 h
h
七、(本题包括2小题,共18分)
24、(8分)m mol Na2O2与NaHCO3的混合物在密闭容器中加热至250℃,使其充分反应,若混合物中Na2O2的物质的量分数为x。
(1)当x=1/2时,容器中固体产物是_________________(写化学式),其物质的量为_____________。
(2)若反应后生成气体是O2和H2O,则x的取值范围___________________________。
(3)若0<x<1/3时,产生气体的物质的量n=________________mol(用m、x表示)
25、石油化工是江苏省的支柱产业之一,醋酸乙烯酯是合成维尼纶的重要单体。某化工厂利用下列反应原理生产醋酸乙烯酯:
2CH2=CH2+O2 2CH3CHO ①
2CH3CHO+O2 2CH3COOH ②
2CH2=CH2+2CH3COOH+O2 → 2CH3COOCH=CH2+2H2O ③
由于副反应的发生,反应①中乙烯的利用率为75%,反应②中乙醛的利用率为80%,反应③中乙酸和乙烯的利用率均为75%。
(1)为使乙酸乙烯酯获得最大产量,乙烯先后两次的投料比为多少?
(2)以2.8×104kg乙烯为原料最多可制得醋酸乙烯酯多少千克?
(3)若各步副反应中反应物物质的量之比均与主反应相同。以乙烯和空气为原料生产醋酸乙烯酯,通入的空气(O2的体积分数为1/5)与乙烯的体积比至少为多少?