高三化学综合练习四
第Ⅰ卷(共64分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 Fe-56 Cu-64 Zn-65 Br-80 Ba-137
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是
①PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
②PVC单体可由PE的单体与氯化氢加成制得
③鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红,则为PE。
④等质量的聚乙烯和乙烯燃烧消耗的氧气相等
⑤PE、PVC、PVDC单体能发生加成反应
⑥PE和PVDC属于体型高分子聚合物,高温难熔。
⑦食品保鲜膜都能发生加成反应,燃烧产物相同。
A.①②④ B. ②⑥⑦ C.③④⑤⑦ D. ②③⑥
2.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.硝酸乙基铵水溶液呈碱性
B.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O=C2H5NH2+H3O+
C.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
D.离子液体可以作为电池的电解质
3.通过复习总结,你认为下列对化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子品体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
![]() 4.实验室用一定量的铁与足量的稀硫酸及足量的CuO为原料制取单质铜,有人设计以下
4.实验室用一定量的铁与足量的稀硫酸及足量的CuO为原料制取单质铜,有人设计以下
两种方案:若按实验规则进行操作,则两种方法制得的单质铜的质量比较,正确的是
A.相等 B. ①多 C.②多 D.无法判断
5.下列离子方程式正确的是
A.Fe(OH)3溶于氢碘酸: Fe(OH)3+3H+=Fe3++3H2O
B.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
C.H218O中投入Na2O2固体: 2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
6.下列画有横线的物质在反应中不能完全消耗的是
A、将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃
B、将1mol Mg置于10L空气中(标况),使之在高温下反应
C、将1mol Cu置于含2mol H2SO4的98%的浓硫酸中加热
D、在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
7.将a g Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2mol·L-1 C.0.4 mol.L-1 D.0.8mol·L-1
8.把NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后消耗盐酸的量,下列说法正确的是
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多
二、选择题(本题包括8小题,每小题4分共32分。每小题有一个或两个选项符合题意。
9.分别配制H3PO4、KOH的乙醇溶液,取10 mL H3PO4乙醇溶液后不断振荡并滴加KOH乙醇溶液,立即产生白色沉淀,并不断增多,继而又逐渐减少至消失,然后又逐渐增多至一定量不再消失。以上事实说明
A、K2HPO4不溶于无水乙醇 B、KH2PO4、K3PO4不溶于无水乙醇
C、KH2PO4、K2HPO4不溶于无水乙醇 D、K2HPO4溶于无水乙醇
10.下列各组离子在溶液中可以大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.NH4+、K+、SO42-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
11.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
B.1L0.1mol/L麦芽糖溶液完全水解后溶液中分子总数为0.2NA
C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
D.常温下,lLpH=9的CH3COONa溶液中,由水电离的氢氧根离子数约为10-5NA个
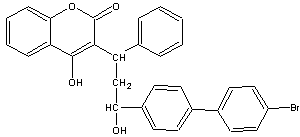 12.溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
12.溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
A.溴敌隆的化学式为C30H24BrO4
B.在碱性条件下水解时,1mol溴敌隆将消耗4molNaOH
C.溴敌隆经水解,酸化后的产物(C30H25BrO5)1mol与足量浓溴水反应,消耗Br2的物质的量为3mol
D.1mol溴敌隆最多可与12molH2发生加成反应
13.工业生产苯乙烯是利用乙苯的脱氢反应:
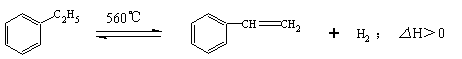
针对上述反应,有人提出如下观点,其中不合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
14.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
B.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
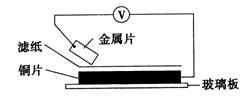 15.将洁净的金属片A、B、C、D分别放置在浸有NaOH溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
15.将洁净的金属片A、B、C、D分别放置在浸有NaOH溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
已知:构成两电极的金属活泼性相差越大,电压表的读数越大。请依据表中数据判断下列说法正确的是
A.A、B、C、D的活动性都强于Cu
B.在A、B、C、D四种金属中B的还原性最强
C.在滤纸上能看到有蓝色沉淀析出的是B
D.产生蓝色沉淀的正极反应为:2Cu+4OH--4e-= 2Cu(OH)2
16.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为4﹕1﹕4时,实际参加反应的FeS与HNO3的物质的量之比为
A.2∶15 B.1∶6 C.2∶3 D.16∶25
第Ⅱ卷(共86分)
三、(本题包括2小题,共20分)
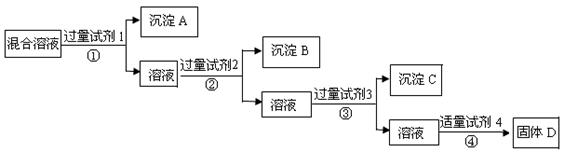 17.(8分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:
17.(8分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:
(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是___________(填操作名称)
18.(12分)阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
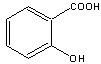
+ (CH3CO)2O ![]() + CH3COOH
+ CH3COOH
(水杨酸) (乙酸酐) (阿斯匹林)
在生成乙酰水杨酸的同时,水杨酸分子间也能发生缩合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
① 向150mL干燥锥形瓶中加入2g水杨酸、5mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90℃条件下反应5~10min。然后冷却,即有乙酰水杨酸晶体析出。
② 减压过虑,用滤液淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量使溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③ 将粗产品置于100mL烧杯中,搅拌并缓慢加入25mL饱和碳酸氢钠溶液,加完后继续搅拌2~3分钟,直到没有二氧化碳气体产生为止。过滤,用5~10mL蒸馏水洗涤沉淀,合并滤液于烧杯中,不断搅拌,慢慢加入15mL4mol/L盐酸,将烧杯置于冷水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
请回答下列问题:
(1) 第①步中,要控制反应温度在85~90℃,应采用_________ 加热方法。用这种加热方法需要的玻璃仪器有__________。
(2) 在第②步中,用冷水洗涤晶体,其目的是___________________________
(3) 第③步中,加入碳酸氢钠的作用是____________________
加入盐酸的作用是________________________
(4) 如何检验产品中是否混有水杨酸?___________________________
四、(本题包括3小题,共29分)
19.(8分)汞单质及其化合物在工业生产和研究上有广泛的用途,汞唯一重要的矿源是朱砂(HgS)。朱砂炼汞的反应之一为:HgS
+ O2
![]() Hg + SO2
Hg + SO2
请完成下列问题:
(1) HgS与O2的反应中,氧化剂是______________,每生成1molHg转移电子的物质的量为__________
(2) 电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是____________(填化学式),由此可推断出该盐的化学式为_____________。其阴极上所发生的还原反应的方程式是___________________________
(3) 随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。请你提出一种处理含汞(Hg2+)废水的方法____________________________
20.(12分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
 (3)将BA4,D2分别通入插在碱溶液中的两个电极形成燃料电池,则通BA4的一极为 极,电极反应式为
。
(3)将BA4,D2分别通入插在碱溶液中的两个电极形成燃料电池,则通BA4的一极为 极,电极反应式为
。
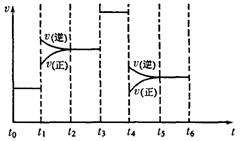
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一
段时间是 。温度为T℃时,将4a
molA2和2a molC2放人1L密闭容器中,充分反应后 测得C2的转化率为50%,则平衡混合气中C2的体积分数为 ,平衡时压强为起始压强的 倍。
(5)化合物A8B2C2D2与烧碱溶液共热,产生使红石蕊试纸变蓝的气体,写出该反应的化学方程式: 。
21.(9分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如右图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题:
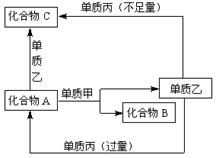 (1)若甲在转化中为还原剂,是常见金属,乙是常见非金属 固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是
;B的电子式是
,A与甲反应的化学方程式是
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属 固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是
;B的电子式是
,A与甲反应的化学方程式是
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是 常见金属,甲、乙、丙中甲由短周期元素组成,乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中通常条件下进行,则:
①A与乙反应的离子方程式为: 。
②C与丙反应的离子方程式为: 。
③当A与甲的物质的量之比为2︰3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为: 。
五、(本题包括2小题,共19分)
22.(9分)已知:(1) 同一个碳原子上连接两个羟基是不稳定的。
(2)碳碳双键有如下的断裂方式:
R'CH=CR2 ![]()
![]() R'COOH + R-
R'COOH + R-![]() -R
-R
R'CH=CH2 ![]()
![]() R'COOH + CO2
R'COOH + CO2
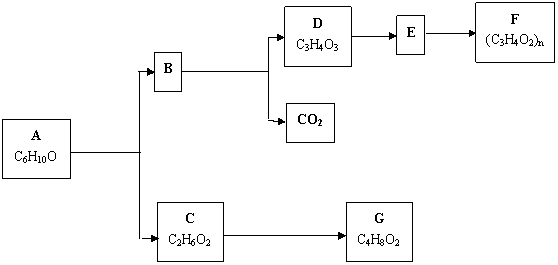 酯A(C6H10O3) 可发生如下图所示的转化:
酯A(C6H10O3) 可发生如下图所示的转化:
| ||||||||||
| ||||||||||
| ||||||||||
| ||||||||||
| ||||||||||
(1) 写出A、D、G的结构简式
A_________ D______________ G______________
(2) 指出相关转化过程的反应类型:
A ![]() B + C ____________ D
B + C ____________ D ![]() E ____ _____________
E ____ _____________
(3) 写出E转化为F的化学方程式_______ ______ _________
23.(10分)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目。
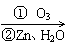 如:(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
如:(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
且已知:CH2=CH-OH(烯醇式结构:碳碳双键连接羟基)不能稳定存在
已知某有机物A经臭氧氧化分解后发生下列一系列的变化:
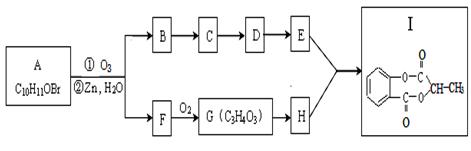
试回答下列问题:
(1)F可能的结构有两种,请写出结构式
、 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)G制取H的化学方程式:
指明反应类型:
(4)1molI最多消耗NaOH mol
六、(本题包括2小题,共18分)
24.(8分)将NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解.用1mol/L稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量的关系如图所示.
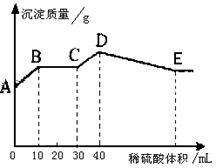 (1)D点所表示的沉淀的化学式是
;
(1)D点所表示的沉淀的化学式是
;
(2)B点所表示的沉淀的质量是 g;
(3)沉淀质量为10.1g时,需加入稀硫酸的总体积是多少毫升?
25.(10分)Fe2O3、ZnO、CuO的混合固体粉末ag,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2用足量的澄清石灰水吸收后,产生5.00g白色沉淀。
(1) a= g
(2) 如agFe2O3、ZnO、CuO的混合物总物质的量为bmol,
则Fe2O3物质的量为 mol(用b的代数式表示)
(3) agFe2O3、ZnO、CuO的混合物溶于足量的盐酸,再加入适量的铁粉,溶液中的Fe3+、Cu2+全部被还原,同时收集到224mLH2(标准状况下),共用去0.03mol铁粉,求原混合物中Fe2O3、ZnO、CuO的物质的量分别为多少?
高三化学综合练习四参考答案
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | B | D | D | C | B | C | B | A |
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 | BD | D | CD | C | AC | B | C | B |
17、(1)氯化钡溶液或硝酸钡溶液 (1分) 硝酸银溶液(1分) 硝酸溶液(1分)
(2) 测定溶液的pH(1分)
(3) 除去溶液中过量的Ba2+、Ag+(2分)
(4) 蒸发、冷却、结晶、过滤(2分)
18、(1)水浴(1分)、酒精灯、烧杯、温度计(3分)
(2) 洗涤晶体表面附着的杂质、(1分)减少阿斯匹林因溶解而引起的损耗(1分)、
(3) 使阿斯匹林转化为可溶性盐(1分),而与不溶性的物质相互分离(1分)。
将阿斯匹林的可溶性盐重新转化为阿斯匹林,从而达到提纯的目的(2分)
(4) 向水中加入少量产品,然后滴加FeCl3溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸(2分)
19、(1) HgS和O2 (1分) 6 (1分)
(2) O2 (1分) Hg2(NO3)2 (2分) Hg22+ + 2e- = 2Hg(2分)
(3) ①向含Hg2+的废水中加入Na2S等可溶性硫化物,② 电解法 ③ 加入金属还原剂等合理的方法均可(1分)
20. (1)10-4:(1分) (2)Ba2++HCO3-+ OH-==BaCO3↓+H2O(2分)
(3)负(1分),CH4+10OH-—8e-==CO32-+7H2O (2分),
(4)t0~t1(2分) 25%(1分) 2/3(1分)
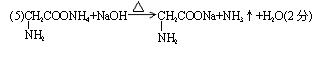
21.(1)O=C=O (1分)
Mg2+[![]() ]2-(1分) 2Mg+CO2
]2-(1分) 2Mg+CO2![]() 2MgO+C (1分)
2MgO+C (1分)
(2)①2Fe2++Br2=2Fe3++2Br-(2分) ②Fe+2Fe3+=3Fe2+(2分)
③2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- (2分)
![]()
![]()
![]()
![]() 22、(1) CH2=C-
22、(1) CH2=C-![]() -O-CH2CH2OH (2分) CH3-
-O-CH2CH2OH (2分) CH3-![]() -COOH (2分) (1分)
-COOH (2分) (1分)
(2) 取代(或水解) (1分) 加成(或还原) (1分)
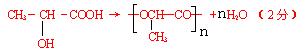 (3)
(3)
23.(10分)(1) CH3COCH2OH、CH3CH(OH)CHO(各2分,共4分)
(2)B(2分)
(3) CH3COCOOH+H2![]() CH3CHOHCOOH(2分)
CH3CHOHCOOH(2分)
加成反应或还原反应(1分)
(4)3 mol(1分)
24.(1)BaSO4 Al(OH)3(各1分)
(2)9.32g(2分)
(3)35ml或55ml(各2分)
25.(1)3.21g (2分)
(2)0.025-1/2b mol (2分)
(3)0.01 mol、0.01 mol、0.01 mol (6分)