高三化学综合练习试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 Na-23 Mg-24
Al-27 Si-28 P-31 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-64 Zn-65 Br-80 Ag-108 I-127 Ba-137
第I卷 (选择题共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.生活中的一些问题常涉及到化学知识,下列叙述不正确的是
A.甘蔗渣可经化学反应制得酒精
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和蚕丝的主要成份都是纤维素
D.目前我国空气质量日报中,被列为空气污染物的有SO2、NO2和可吸入颗粒物
2.下列叙述正确且相关变化属原电池反应的是
A.马口铁(镀锡铁)表面有划损时,也能阻止内部的铁被氧化
B.在空气中金属铝表面迅速被氧化形成保护膜
C.红热的铁丝与水接触表面可形成蓝黑色保护层
D.在铁与稀硫酸反应时,加几滴CuSO4溶液,可加快H2的产生
3.取100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是
A.加入适量的6 mol/L的盐酸 B.用酒精灯适当加热
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
4.下列实验或生产操作:(1)蛋白质溶液中加入饱和硫酸铵溶液后形成沉淀(2)除去混在氢氧化铁胶体中的氯化铁(3)NO2经过加压冷凝成无色的液体(4)溴水中滴入植物油振荡后褪色(5)水泥、砂子和水混合后硬化(6)照片底片感光;其中没有新物质生成的是
A.(1)(2)(3) B.(2)(4)(6) C.(1)(2) D.(3)(5)
5.下列关于硼元素的叙述,正确的是
A.从硼的相对原子质量为10.8,可判断硼原子的核内中子数为6个
B.在三氯化硼分子中,硼原子最外层满足了8电子结构
C.硼元素可以和氢元素结合成为氢化物
D.硼原子与羟基结合所形成的化合物是一种强碱
6.下列操作正确的是
A.用冷却结晶法除去氯化钠中混有的少量硝酸钾
B.用湿润的pH试纸测定某溶液的pH
C.检验卤代烃中的卤素时,取样加入NaOH溶液加热后,加硫酸酸化再加入AgNO3溶液
D.用饱和碳酸钠溶液来除去乙酸乙酯中混有的乙酸、乙醇杂质
 7.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
7.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
则符合上述条件的酯的结构可有
A.2种 B.4种 C.6种 D.8种
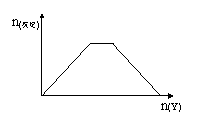 8.向X的溶液中,加入Y试剂,产生的沉淀示意图如下图所示情形的是(注意线段的斜率)
8.向X的溶液中,加入Y试剂,产生的沉淀示意图如下图所示情形的是(注意线段的斜率)
A.向NaOH和Ca(OH)2的混合液中通入CO2
B.向HCl和AlCl3的混合液中滴加NaOH
C.向NH4Cl和AlCl3的混合液中滴加NaOH
D.向NH4Cl和MgCl2的混合液中滴加NaOH
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.下列离子方程式正确的是
A.硫酸氢钠溶液中加入氢氧化钡至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.向漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO![]()
![]()
C.向苯酚钠溶液中通入少量的CO2: + CO2 + H2O → + HCO3-
D.偏铝酸钠溶液中通入过量的CO2:CO2+2H2O+AlO2- =Al(OH)3↓+HCO3-
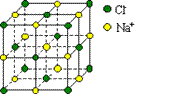 10.设阿伏加德罗常数为NA mol-1,下列说法正确的是
10.设阿伏加德罗常数为NA mol-1,下列说法正确的是
A.0.1mol碳酸钠晶体[Na2CO3·10H2O]中含有离子总数大于0.3NA
B.标准状况下,1L己烷完全燃烧后生成![]() NA个CO2分子
NA个CO2分子
C.1mol NaCl晶体中含有右图所示的结构单元的数目为0.25NA
D.常温常压下,15.6 g Na2O2与过量的CO2反应时,转移的电子数为0.2NA
11.在某溶液中加入铝粉反应生成氢气,则在该溶液中一定能大量共存的是
A.NH4+、Na+、SO42-、NO3- B.Cu2+、Cl-、Mg2+、SO42-
C.Ag+、K+、Ba2+、NO3- D.K+、Cl-、Na+、SO42-
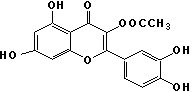 12.取1mol有机物甲(分子结构如下图),与足量的溴水或NaOH溶液反应,最多消耗的Br2与NaOH分别是
12.取1mol有机物甲(分子结构如下图),与足量的溴水或NaOH溶液反应,最多消耗的Br2与NaOH分别是
A.5mol、5mol B.5mol、6mol C.6mol、5mol D.6mol、6mol
13.将0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混和后,混合液中微粒浓度关系正确的为
A.c(CH3COO-)>c(Na+) B.c (CH3COOH)+ c (CH3COO-)=0.02mol/L
C. c (CH3COOH)>c (CH3COO-) D.2c (H+) = c (CH3COO-)+2c(OH-)-c (CH3COOH)
14.质量分数不等的两种硫酸溶液等质量混合时,所得硫酸溶液的质量分数为a%,而等体积混合后所得硫酸溶液的质量分数为b%;质量分数不等的两种酒精溶液等质量混合时,所得酒精溶液的质量分数为a%,而等体积混合后所得酒精溶液的质量分数为c%。则a、b、c的大小关系正确的是
A.a>b>c B.b>a>c C.c>a>b D.c>b>a
15.相同温度下,将pH=2的某一元酸溶液和pH=12的某一元碱溶液等体积混合,所得溶液呈碱性,则下列说法正确的是
A.生成强碱弱酸盐,酸和碱都不剩余 B.生成强碱弱酸盐,酸剩余
C.生成强碱弱酸盐,碱剩余 D.生成强酸弱碱盐,碱剩余
16.在某稀溶液中含有0.1mol HNO3和0.1mol H2SO4,向其中加入9.6g 铜粉,充分反应后产生的气体在标准状况下的体积为
A.1.12L B.1.68L C.2.24L D.3.36L
第II卷 (非选择题共86分)
三、(本题包括17、18两题,共19分)
17.(6分)下列实验操作或对实验事实的叙述正确的是_________________(填序号)。
① 用稀硝酸清洗做过银镜反应实验的试管;
② 配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加到浓硫酸中,并不断搅拌;
③ 用碱式滴定管量取20.00mL 0.1000mol/L KMnO4溶液;
④ 用托盘天平称取10.50g干燥的NaCl固体;
⑤ 不慎将苯酚沾到皮肤上,立即用酒精清洗;
⑥ 用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦ 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧ 配制Al2(SO4)3溶液时,加入少量的稀硫酸;
⑨ 用硫酸催化淀粉水解后,欲检验生成的产物,必须要先加入氢氧化钠溶液至呈碱性
18.(13分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:


⑴指出提取碘的过程中有关的实验操作名称:I__________,III__________;
写出过程II中有关反应的离子方程式:__________________________________________。
⑵现用CCl4从含碘的水溶液中提取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧怀接收溶液
F.将分液漏斗上口倒出上层水溶液
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
H.静置,分层
就此实验,完成下列填空:
①正确操作步骤的顺序是 ___→___ →___ → A → G → ___ → E → F (用上述各操的编号字母填写)
②上述(G)步骤操作的目的是_____________________________________。
③过程III中,能和CCl4起到相同作用的溶剂是下列物质中的_____________(用序号填空)。
a.热裂汽油 b.苯 c.酒精 d.正庚烷 e.甲苯 f.乙酸 g.甘油
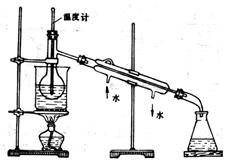 ⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出右图所示实验装置中的错误之处:
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出右图所示实验装置中的错误之处:
①______________________________________,
②______________________________________,
③______________________________________。
⑷进行上述蒸馏实验操作时,使用水浴的原因是_______________________________,最后晶态碘在_________里聚集。
四、(本题包括19、20、21三题,共27分)
19.(8分)如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(?)+B(?) ![]() x C(g);ΔH<0 。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
x C(g);ΔH<0 。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。
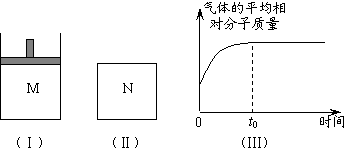

⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可能填不满):
| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z = y | 无法比较 |
| ② | ||||
| ③ | ||||
20.(12分)下列框图表示某些物质之间的相互转化关系。其中A是一种灰黑色固体单质、有金属光泽,1molA能与60molC恰好完全反应,1molA与3molB化合形成X;F在无色火焰上灼烧时透过蓝色钴玻璃观察可以看到淡紫色。R是一种传统的汽油添加剂(现己被普遍禁用),R与C完全反应生成D、G与水,且D、G、水的物质的量之比为8∶1∶10。试根据图中所揭示的信息回答下列问题:
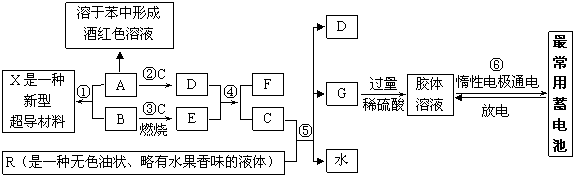
⑴A、R、X的化学式依次分别为 ; ; ;
⑵D与E反应生成F和C的化学方程式为 ;反应中每生成1molC转移 mol电子;
⑶R被普遍禁用,主要是因为 ;
⑷⑥中电池充电时的阴极反应式、放电时的正极反应依次分别为
、 。
21.(7分)⑴我国历史上曾经将硫酸称作“绿矾油”,这是因为人们最初是通过强热绿矾[FeSO4·7H2O]获得硫酸的(同时得到用于制作陶瓷的红色颜料)。试写出绿矾分解的这一化学方程式: ;
上述工艺在近代已被逐渐淘汰,它的缺陷是__________________________(答一种即可)。
⑵用黄铜矿(主要成份CuFeS2,一般伴生主要成份是SiO2的矿物——“脉石”)炼铜时的冶炼反应可看做是按如下方式分步进行的:
①黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;
②硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣FeSiO3;
③硫化亚铜与氧气反应生成氧化亚铜;硫化亚铜与氧化亚铜反应生成铜、二氧化硫。
理论上,炼铜时O2与黄铜矿中CuFeS2的最佳配比应该是 ;
铜冶炼厂最好与 厂及 厂联合生产以实现原料的充分利用。
五、(本题包括22、23两题,共22分)
22.(10分)现有A、B两种有机化合物,已知:
①A、B分子含有相同数目的碳原子和氧原子,A分子侧链上一个氢原子被氨基取代后得到B;
②A、B分子氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③A、B都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵ A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是________________________;
⑷如果B是天然蛋白质水解的最终产物,则B的结构简式为 ;
⑸B有一同分异构体D是苯环上的一硝基取代产物,其苯环和侧链上的一溴代物各有两种,D的结构简式是__________________________。
23.(12分)已知: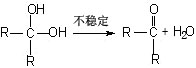 ,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应而J有一种同分异构体能发生银镜反应):
,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应而J有一种同分异构体能发生银镜反应):
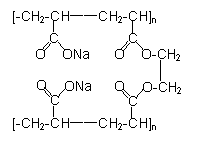
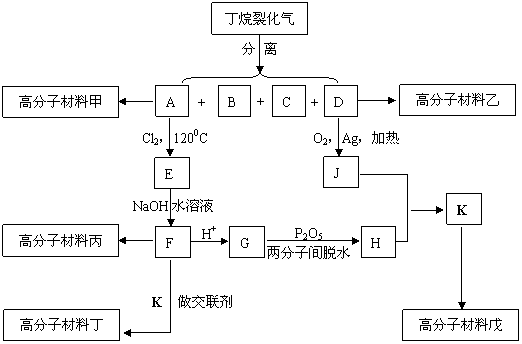

丁的结构简式为: ,1kg优质材料丁最多能吸收近800kg水。
(1)分离丁烷裂化气中各种成分的操作方法为 ;
(2)指出下列有机反应所属的反应类型:A→E属于 反应,J+H→K属于 反应;
(3)E→F的化学方程式为(有机物一律写结构简式)
;
(4)试依次分别写出丙、戊的结构简式:
、 ;
(5)在甲、乙、丙、戊四种高分子材料中 (填“甲”“乙”“丙”或“戊”中的一种或多种)不可能具有强大的吸水能力。
六、(本题包括24、25两题,共18分)
24.(8分)金属钠和铅以物质的量之比2∶5组成的合金可以部分溶于液态氨,得到深绿色的溶液A,残留的固体是铅,溶质与残留固体的质量比为9.44∶1。溶液A可以导电,经实验证实,溶液A中除液氨原有的少量离子(NH4+离子和NH2-离子)外,只存在一种阳离子和一种阴离子(不考虑溶剂合离子),而且它们的个数比是4∶1,每个阳离子只带一个电荷。通电电解时,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到滴定终点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。[M(Pb)= 207.2 g/mol]
(1)溶液A中的电解质的化学式为 (折算为<10的整数的比);
(2)写出上述滴定反应的离子方程式并配平: ;
(3)已知用于滴定的碘化铅的浓度为0.01000 mol·L-1,达到终点时消耗碘化铅溶液20.00mL,问共析出金属铅多少克?
25.(10分)以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:
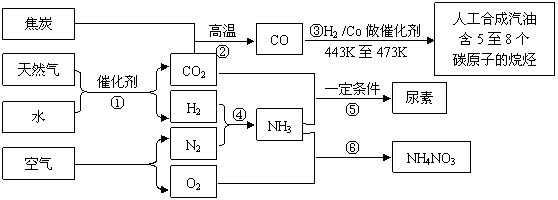

(1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油。
i 通过计算说明:为什么上述方案不能得到理想的产品;
ii 若要得到理想的产品,则CO2的使用量应控制为反应①中CO2产量的______________(填倍率和倍率的范围);
(2)通过反应④、⑥合成硝酸铵。若每步反应的转化率均超过95%,则最后得到的全部产物中,N元素质量分数是多少?
(3)通过反应①、④、⑤合成尿素。若反应④中N2和H2的投料比为V(N2)∶ V(H2)=1∶3,氨合成塔中NH3的体积分数始终保持在25%,要使N2的最终转化率超过95%,则N2和H2至少需要经过 次循环。