高三化学综合试题(一)
第I卷(选择题 共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是( )
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
2.据报道,用10B合成的10B20有非常好的抗癌治癌作用。下列叙述正确的是( )
A.10B和10B20互为同位素 B.10B和10B20互为同分异构体
C.10B的中子数和核外电子数相等 D.10B20晶体熔点高、硬度大
3.下列每组物质发生状态变化时所克服的粒子间的相互作用属于同类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
4.据报道,2002年10月26日俄罗斯特种部队在解救人质时除使用了非致命武器芬太奴外,还使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有 ( ) A.4种 B.3种 C.2种 D.1种
5.已知98%的浓硫酸的物质的量浓度是18.4 mol/L ,则49%的硫酸溶液的物质的量浓度是(单位:mol / L) ( ) A.=9.2 B.<9.2 C.>9.2 D.不能确定
6.已知氢化锂(LiH)属于离子晶体,LiH跟水反应可以放出氢气,下列叙述正确的是( )
A LiH的水溶液呈中性 B LiH是一种强氧化剂
C. LiH中的氢离子可以被还原成氢气 D. LiH中氢离子与锂离子核外电子排布相同
7.1g氢气完全燃烧生成液态水放出142.9kJ的热量, 表示该反应的热化学方程式中, 正确的是 ( )
A、2 H2(g) + O2(g) = 2 H2O(l);△H =-142.9kJ/mol
B、2 H2(g) + O2(g) = 2 H2O(g);△H =-571.6kJ/mol
C、2 H2 + O2 = 2 H2O;△H =-571.6kJ/mol
D、H2(g) +![]() O2(g)
= H2O(l);△H =-285.8kJ/mol
O2(g)
= H2O(l);△H =-285.8kJ/mol
8.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。A、B、C、D间形成最稳定化合物的化学式为( )
A.D2A B.C2B C.D2B D.C2A
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。
9..设NA表示阿伏加德罗常数,下列说法不正确的是( )
A.a g H2和b g He在同温同压时的体积比为a∶2b
B.2 L 0.1 mol/L的H2S溶液中,含有的H2S分子数小于0.2NA
C.78 g Na2O2与水充分反应,转移的电子数目为NA
D.1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA
10.下列离子方程式书写正确的是( )
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合:
Ba2++2OH-+2HCO![]() ====BaCO3↓+CO
====BaCO3↓+CO![]() +H2O
+H2O
B.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH溶液混合:
NH![]() +HCO
+HCO![]() +2OH-= NH3·H2O+CO
+2OH-= NH3·H2O+CO![]() +H2O
+H2O
D.明矾溶液中加过量Ba(OH)2溶液
2A13++3SO![]() +3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
11.体积相同,H+离子浓度均为0.1 mol/L的CH3COOH溶液、盐酸,分别加水稀释m倍、n倍,溶液的pH都变成5,则m与n的关系为( )
A.m>n B.m=n C.m<n D.无法确定
12.某恒温恒容的容器中,建立如下平衡:2A(g)![]() B(g),若在相同条件下分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
B(g),若在相同条件下分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减少后者增大
13.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的是( )
A.c(Na+)+c(H+) c(HCO3-)+c(CO32-)+c(OH-) B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
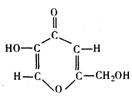 14.从米曲霉中分离出的曲酸是—种新型添加剂,其分子结构如下图。曲酸具有抗氧化性(保护其它物质不被空气氧化),在化妆、医药、食品、农业等方面具有广泛的应用前景。下列关于曲酸的说法正确的是
14.从米曲霉中分离出的曲酸是—种新型添加剂,其分子结构如下图。曲酸具有抗氧化性(保护其它物质不被空气氧化),在化妆、医药、食品、农业等方面具有广泛的应用前景。下列关于曲酸的说法正确的是
A. 曲酸是一种芳香族化合物 B.曲酸是一种羧酸,难溶于水
C. 曲酸分子中的所有原子不可能都在同一平面上
D. 曲酸被空气中的O2氧化时,反应发生在环上的羟基部位
15.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体 B.若Y的原子序数为n,X的原子序数一定是n土4
C.X和Y可属于同一周期,也可属于两个不同周期 D.X和Y可属于同一主族
16.按图装置实验,若x轴表示流入阴板的电子的物质的量,则y轴应表示
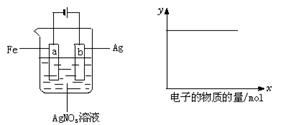
①c(Ag+) ②c(NO![]() ) ③a棒的质量 ④b棒的质量
⑤溶液的pH
) ③a棒的质量 ④b棒的质量
⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
第II卷(非选择题 共78分)
三、(本小题包括2小题,共20分)
17.(8分)⑴取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是___________
_________________________________________________________,比较生成H2快慢的方法是___________________________________________________________。
⑵做溴乙烷水解实验时,不断振荡溴乙烷与NaOH溶液混合物的作用是___________
__________________________________,溴乙烷已完全水解的现象是_________________
________________________________________。
18.(12分)下图装置为模拟工业制纯碱,在饱和食盐水中通入NH3和CO2即有NaHCO3析出,若NH3气体流向自左向右,CO2气体流向自右向左,
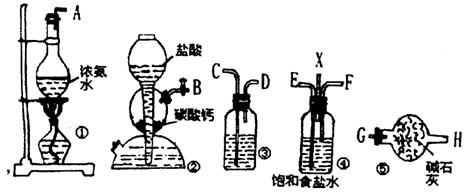
试回答: (1)各装置玻璃管接口的连接顺序为
( )接( ), ( )接( ), ( )接( ), ( )接( )。
(2)装置③装的试剂是 ,作用是 。
(3)装置④中X的作用是___________。
(4)先通NH3还是先通CO2?为什么?____________。
(5)若制得NaHCO3晶体之后欲得到纯碱,应采取的方法是___________,有关的化学方程式为_________________________________________。
四、(本题包括2小题,共22分。)
19.(10分)⑴常温下某无色透明溶液中所含的离子仅有NH4+和Cl-等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有_______________(填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能,填写下面的两种可
能:Cl->______>______>______ Cl->______>______>______
③如溶液中c(NH4+)=c(Cl-),则溶液中的溶质为_______________________(填化学式)。该溶液的pH_____7(填<、>或=)
(2)高温下,向1mol 赤热的硫化铜中通入足量的水蒸气,生成2mol 氢气,同时还生成金属铜和一种刺激性气味的气体。
①该反应的化学方程式是________________________________________________。
②该反应中氧化产物是_______________。
③每生成1 mol H2氧化剂与还原剂之间转移的电子是______________mol。
20.(12分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中反应物和生成物未全部给出,反应条件也未注明。
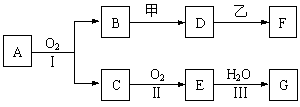 |
⑴若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________________________________________________。
②B的水溶液与甲反应的离子方程式是__________________________________。
③D的水溶液和F的水溶液中由水电离出的c(OH-)___________(填字母序号)。
(a).前者大 (b).后者大 (c).一样大 (d).不知浓度,无法比较
⑵若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅰ在_______________中进行,反应Ⅲ在_______________(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是___________或_____________。
③D和乙反应的离子方程式是______________________________。
五、(本题包括2小题,共18分。)
21.(6分)聚氨酯是主链上含有![]() 重复结构单元的一种新型高分子化合物,在高档家具所用底发泡材料方向用途广泛。其单体是异氰酸酯(如O=C=N–R–N=C=O)和多元醇(如HO–R’–OH),高聚物结构简式为:
重复结构单元的一种新型高分子化合物,在高档家具所用底发泡材料方向用途广泛。其单体是异氰酸酯(如O=C=N–R–N=C=O)和多元醇(如HO–R’–OH),高聚物结构简式为: ![]() 。
。
(1)由上述异氰酸酯和多元醇合成高聚物的反应类型为_____________。
(2)某聚氨酯类高聚物结构简式为: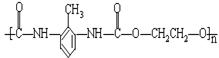 ,它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:A_______B________。
,它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:A_______B________。
22.
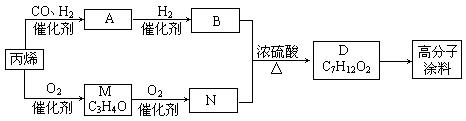 |
(12分)有一种广泛用于汽车、家电产品上的高分子涂料,按下列流程图生产。流程图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
填写下列空白:
⑴物质的结构简式:A___________________,高分子涂料______________________。
⑵写出下列转化的反应类型:A→B________________,B→D_______________。
⑶写出下列反应的化学方程式:
A发生银镜反应:_______________________________________________,
B与N反应生成D:_______________________________________________。
六、(本题包括1小题,共8分)
23、在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
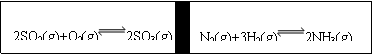
⑴若其始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后(两侧温度相同),隔板是否可能在、仍处于中央 (填“可能或不可能”)
⑵起始时投入2molSO2、1molO2;1molN2、2molH2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字)
⑶若起始时投入2molSO2、1molO2;1molN2、amolH2、0.1molNH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
⑷若起始时投入2molSO2、1molO2,欲用简单方法粗略测定平衡时SO2的转化率,则可将左侧的平衡混合气体中通入足量的 (填序号)
A、碳酸钠与碳酸氢钠混合溶液 B、氯化钡溶液
C、98.3%的浓硫酸 D、硝酸钡混合溶液
七、(本题包括2小题,共18分)
24(8分)在20 ℃时食盐的溶解度为36 g,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出气体5.6 L(标准状况)时,食盐刚好电解完。试计算:
(1)电解时所取饱和食盐水的质量是多少克?
(2)要使溶液恢复到原状态,需要加入 克的 (填物质名称)
25.(10分)取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体的体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | ① | ② | ③ | ④ | ⑤ |
| 硝酸体积 | 100mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余物的质量 | 17.2g | 8 g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24L | 4.48L | 6.72L | 7.84L | 7.84L |
⑴该实验中所用硝酸的物质的量浓度为_____________。
⑵第①次实验后所得剩余物的成分是_________________(填化学式,无需算出各成分质量,下同)、第②次实验后所得剩余物的成分是_________________。
⑶求实验中每次所取混合物中铜的质量。
高三化学综合试题(一)
参考答案及评分建议
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.C 2.C 3.C 4.A 5.B 6.D 7.D 8.D
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。
9.AD 10.C 11.A 12.B 13.B 14.B C 15.CD 16.D
三、(本题包括2小题,共20分)
17.⑴排除锌的颗粒大小、纯度等因素对化学反应速率的影响,使影响反应快慢的唯一因素是c(H+) 比较收集相同体积的H2所需时间(或比较相同时间内收集H2的体积)
⑵增大溴乙烷与NaOH溶液的接触面积 将混合液静置看是否分层,若不分层说明溴乙烷已完全水解 (每空2分,共8分)
18.(14分)
(1)(5分)A接C,H接F,E接D,C接B
(2)饱和NaHCO3溶液(1分),除去CO2中的HCl气(1分)
(3)保持瓶内外气压平衡(1分)
(4)先要通NH3(1分),因NH3在食盐水中溶解度大,溶解后吸收CO2的量多,反应后生成NaHCO3的量也多(2分)
(5)①加热法(1分) ②2NaHCO3![]() Na2CO3 +CO2↑+H2O(2分)
Na2CO3 +CO2↑+H2O(2分)
四、(本题包括2小题,共22分)
19.⑴①H+、OH- ②Cl->NH4+>H+>OH- Cl->H+>NH4+>OH-
③NH4Cl、NH3·H2O =
(2)①Cu2S+H2O![]() 2Cu+2H2↑+SO2↑ ②SO2 ③3
2Cu+2H2↑+SO2↑ ②SO2 ③3
(方程式2分,其他每个1分,共9分。)
20.⑴①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
②2Na2O2+2H2O=4Na++4OH-+O2↑ ③(b)
⑵①沸腾炉 吸收塔 ②点燃 光照 ③Fe+2Fe3+=3Fe2+
(每小题2分,共12分。)
五、(本题包括2小题,共18分)
21.(1)加聚反应 (2) O=C=N–C6H4–N=C=O HO–CH2CH2–OH (每空2分)
22.⑴CH3CH2CH2CHO ![]()
⑵加成反应(还原反应) 酯化反应(取代反应)
⑶CH3CH2CH2CHO+2Ag(NH3)2OH![]() CH3CH2CH2COONH4+2Ag↓+3NH3↑+H2O
CH3CH2CH2COONH4+2Ag↓+3NH3↑+H2O
CH2=CHCOOH + CH3CH2CH2CH2OH![]() CH2=CHCOOCH2CH2CH2 CH3+H2O
CH2=CHCOOCH2CH2CH2 CH3+H2O
(前4空每个1分,后2空每空2分,共8分。)
六、(本题包括1小题,共8分)
23、(1)不可能
(2) 2 : 1 (2分)
(3) 1.3 < a < 1.9 (4分)
(4) B C (2分)
七、(本题包括2小题,共18分)
24.(1)110.5g (2)18.25g 氯化氢 (每空2分)
25.⑴由第①组数据可知固体有剩余。反应顺序上应是Fe先生成 Fe(NO3)2,然后 Cu生成 Cu(NO3)2,不管后一步有没有发生,根据方程式可知:
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
n(NO)=0.1mol,n(HNO3)=4 n(NO)=4mol=0.4mol
c(HNO3)= 4mol/L (2分)
⑵由①、②组数据分析,两次剩余物的质量相差9.2g,根据9.2g与再生成的2.24LNO气体的关系,可知这9.2g中应Fe和Cu两种金属都有。
第①次实验后剩余金属为Fe和Cu、第②次实验后剩余金属只有Cu。 (共2分)
⑶由上分析可知,第二次实验后剩余铜8 g,而与第一次相比少掉的9.2g中Fe和Cu都有。设:这9.2g中Fe的物质的量为x mol和Cu的物质的量为y mol。
56 g·mol-1·x mol+64 g·mol-1·y mol=9.2 g (1分)
2(x+y) mol=3×![]() (1分)
(1分)
解得y=0.1mol,质量为6.4g。 (2分)
每次所取混合物中铜的质量6.4g+8 g=14.4g (2分)