高三化学联合体二轮复习试卷第十九题专项训练
1、已知A、B、C、D四种短周期元素原子序数依次增大,并依C、D、B、A顺序原子半径逐渐减小。且知A、C同主族,B、D同主族;B、D两原子核外电子数之和为A、C的原子核外电子数之和的两倍;C元素与其它三种元素均能形成离子化合物。试回答下列问题:
(1)元素B的原子结构示意图为__________________。
(2)用电子式表示C、D形成的化合物的形成过程_______________________________。
(3)写出同时含有上述四种元素的化合物反应的离子方程式_______________________。
(4)a、b、c、d、e五种常见共价化合物分子分别由上述四种元素中的两种构成,其中只有a、c、d为三原子分子,c与e分子中原子核外电子数相同,且知a、e均具有漂白性,b、c两分子以一定比例混合共热可得a、d两种分子,试写出有关化学反应方程式:
①a+e:___________________________________________;
②b+c→a+d:_____________________________________。
(1)![]()
(2)2Na·+∶S∶→Na+[:S:]2-Na+ (3)H++HSO3-=H2O+SO2↑
(4)①SO2+H2O2=H2SO4 ②3SO3+H2S=4SO2+H2O
2、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式:
_ ________________________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
![]() ⑴S2—+H2O HS—+OH— HSO3—+H+=H2O+SO2↑
⑴S2—+H2O HS—+OH— HSO3—+H+=H2O+SO2↑
⑵3S+6OH—=2S2—+ SO32—+3H2O
⑶HS—+OH—=S2—+H2O
3、X、Y、Z是短周期元素的三种常见氧化物.X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是________;Y和X的组成元素相同,Y的化学式是________;1 mol Z在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,Z的化学式是________,其中和产物的化学式是________.在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是________.
![]() ,(2分)
,(2分)
![]() ,(2分)
,(2分) ![]() ,(2分)
,(2分)
![]() 、
、![]() ,(2分)
,(2分) ![]()
![]()
![]() (2分)
(2分)
4、已知A、B、C、D均为短周期元素,它们的原子序数依次增大。A是最外层为一个电子的非金属元素,C原子的最外层电子数是次外层的3倍;C 和D 可形成两种固体化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物,由A、B、C三种元素可形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C = 4:2:3,请回答下列问题:
(1)写出C和D形成的淡黄色固体化合物的电子式______________________
(2)元素原子的物质的量之比为A:B:C:D = 4:2:3的晶体名称为____________,其水溶液显____________性,其反应的离子方程式为________________________________
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的粒子的符号(举两例)__________________ ______________________
(4)写出由B、C元素组成元素原子质量比为B:C = 7 :12的化合物的化学式________________.
(1) 略 (2)硝酸铵;酸;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)NH4+、H3O+ (4)N2O3;
5、现有下列短周期元素性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10—10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| –2 | –3 | –1 | –3 |
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第
族(注:将零族看作VIIIA族)。
(1)④和⑦(1分)①③⑦(1分) (2)⑥(1分)
(3)Al2O3+2KOH→2KAlO2+H2O(2分)
(4)8–n(1分)。23种(1分),1种(1分),七和VIIIA族(答对其中1个得1分)
6、不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
(1)0.93~1.57
(2)非金属性越强,电负性越大,金属性越强,电负性越小 (3)氮原子
(4)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;
将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物。
7、发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
![]()
![]() N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
![]()
![]() N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
据此你可得出的结论是 ▲ (填字母)。
A.肼水解显酸性 B.肼在水中电离出H+
C.肼是二元弱碱 D.肼是二元弱酸
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 ▲ 。
⑶ 25℃时,0.2 mol·L-1 氨水与0.2 mol·L-1HCl 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7)。则混合溶液中由水电离出的c(H+) ▲ (填“大于”、“等于”或“小于”) 0.2 mol·L-1HCl 溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)= ▲ (用含有a的关系式表示)。
(1)C (2) 2NH3 NH4+ + NH2
(3)大于 1×10a-14 (每空2分,共8分)
8、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
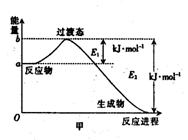 _____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
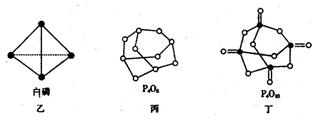
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol—1 | 198 | 360 | 498 | X |
已知白磷(P4)的燃烧热为2982 kJ·mol—1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1(2分)
(3)585(2分)
(4)发638kJ·mol-1(2分)
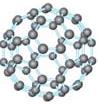 9、20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
9、20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
⑴ N60分子中每个N原子最外层有 个电子;
⑵ N60稳定性较差的原因可能是 ;
⑶ 1molN60受热分解为N2时放出的热量为 ;
⑷ N60潜在的商业用途可能是 。
⑴ 8 ⑵ N-N的键能较小 ⑶ 13 230kJ ⑷ 用作高能量的炸药或火箭燃料
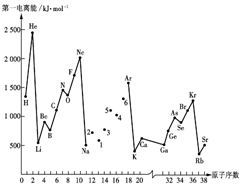
10、第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中5号元素在周期表中的位置是________________________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________。
(1)见上图(右)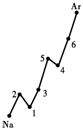 (2分)
(2分)
(2)从上到下依次减小 (2分)
(3)第三周期,ⅤA族 (2分)
(4)因同主族上一周期的元素的氢化物分子间存在氢键 (2分)
11、化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:
H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:KJ·mol-1)
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH= —QKJ/ mol;通过计算确定热化学方程式中Q的值为 。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是_________________________________。
(4)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
。
(1)小于 (2分) 218~330 KJ·mol-1 (2分)
(2)185 (2分) (3)RI> RBr > RCl > RF(2分)
(4)不赞同,H2O的熔沸点高于H2S是因为水分子间存在氢键,与键能无关。(2分)
12、二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程大致如下:
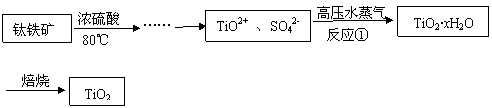 |
(1)反应①的离子方程式为 ,高压水蒸气的作用是
。
(2)用金红石主要成分(TiO2)制取颜料钛白粉(TiO2),涉及的工业流程大致如下:
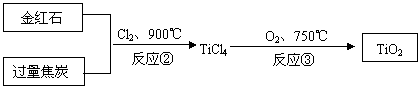 |
反应②的化学方程式 。
反应③的化学方程式 。
(1)TiO2++(x+1)H2O
![]() TiO2·xH2O
+2H + (3分)
TiO2·xH2O
+2H + (3分)
提供水解所需要的大量水和热量,促进水解趋于完全。(3分)
(2) TiO2+2Cl2+2C 900℃ TiCl4+2CO (2分)
TiCl4+O2 750℃ TiO2 + 2Cl2 (2分)
13、A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B________,D________。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:________。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:________________________________________________________。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为_________________________________________________。
(1)F、Mg;(2)2Na2O2+2CO2=2Na2CO3+O2;(3)2F2+2NaOH=2NaF+H2O+OF2;(4)c(Na+)>c(F-)>c(OH—) >c(H+)
14、科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为![]() (→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 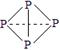 ,请画出N4H44+的结构式 。
,请画出N4H44+的结构式 。
⑷ 已知液氨中存在着平衡2NH3![]() NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
(1)D (2分)(2)不能 (2分) (3)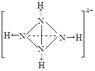 (3分)
(3分)
(4)8NH3 + 4CsOH = N4 + 4CsNH2 + 6H2↑+ 4H2O(3分)
15、已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________、___________________、___________________
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式_______________________________________________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是_________.
(1)H O
(2)![]() (共3分)氮化钠氢化钠也对
(共3分)氮化钠氢化钠也对
(3) NH4NO3 NH![]() +OH―
+OH―![]() NH3↑+H2O (4分)
NH3↑+H2O (4分)
(4)原子晶体 (2分)
16、随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土金属,广泛分布于各种矿物中,钾钒铀矿的化学式为K2H6U2O15(其中钒元素的化合价为+5价),若用氧化物的形式表示,该化合物的化学式为__________.
(2)测定钒含量的方法是先把钒转化为V2O5,V2O5在酸性条件下转化为VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列化学方程式:
___VO2++___H2C2O4→___VO++___CO2+___H2O,
其中还原剂是_________,若反应消耗0.9g草酸,则反应过程中转移的电子数目为________.
(1)K2O·V2O5·2UO3·3H2O
(2)1,1,1,2,1;H2C2O4;1.204![]() 1022
1022
17、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为 ,F中既存在离子键又存在 共价键(填“极性”或“非极性”。)
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
>
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式: 。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式: 。
(1)1:2 非极性
(2)HClO4>H2SO4
(3)Cl2+2OH-=Cl-+ClO-+H2O
(4)NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑
18、A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E的正二价阳离子电子层结构与氩原子相同。
请按要求回答下列问题:
⑴画出E原子的原子结构示意图 ,写出由A和C组成的含有非极性键的化合物的电子式 。
⑵由上述元素组成的化合物中属于极性键构成的非极性分子是
(只要求写出两种,用化学式表示)。
⑶由C与E形成的化合物高温时与单质B反应生成两种化合物,请写出该反应的化学方程式 。
⑷写出上述元素形成的化合物或者单质中:①一种可溶性的正盐与另一种强酸反应的离子方程式 ;②上述元素形成的化合物中通常能污染空气的是 (至少写出两种)。③某一种可污染空气的化合物与强氧化性单质常温下反应生成两种化合物,该反应的化学方程式为 。
 ⑵CH4
、 CO2、CS2
⑵CH4
、 CO2、CS2
⑶CaO+3 C ![]() CaC2+CO↑
CaC2+CO↑
![]()
③H2S+O3=SO2+H2 O
19、有A、B、C、D、E、F六种元素,已知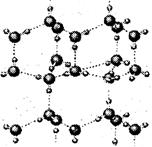 :它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
:它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
(2)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示___________,与每个“构成粒子”相邻的粒子呈______________空间构型。A与D按原子个数比l∶l形成的化合物的电子式为__________________。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C—D | D—D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体。熔点由高到低的顺序(用a、b、c表示):_________________
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质品体的燃烧热:_____________________________________
(1)NaHCO3 (1分)CH3COONa(1分)(或其它有机酸的盐)
(2)氢键(1分) 正四面体(1分) HOOH( 2分)
(3)①acb (2分)②990.7kJ/mol(2分)
20、长期以来一直认为氟的含氧酸不存在。但是之1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。
⑴以下两种结构式,能正确表示次氟酸结构的是 ,理由是 。
A.H—O—F B.H—F—O
⑵次氟酸中氧元素的化合价为 ,次氟酸的电子式为 ,次氟酸分子中共价键的键角 180°(填“<”或“=”)
⑶下面给出了几个分子和基团化学键的键能:
| H2 | O2 | F2 | OH | OF | HF | |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
请计算反应:2HOF=2HF+O2的反应热(△H)的近似值为 kJ/mol。
请从计算结果预测次氟酸的一条化学性质: 。
⑷次氟酸刹那间能被热水所分解,生成一种常见的物质M,该物质既表现有氧化性(对于碘化钠),又表现有还原性(对于高锰酸钾),则M的化学式为 ,写出次氟酸与热水反应的化学方程式: 。
⑸写出能够加快M分解的两种催化剂 和 (写化学式)。
⑴A(1分),A中O和F原子的最外层电子数等于8,B中O和F原子的最外层电子数不等于8(1分)
⑵O(1分),![]() (1分),<(1分)
(1分),<(1分)
⑶—338(2分),次氟酸不稳定,易分解为HF和O2(1分)
⑷H2O2(1分)HOF+H2O(热)=H2O2+HF(1分)
⑸MnO2 、FeCl3(2分)
有X、Y、Z三种元素,其原子序数依次增大,且位于同一周期,它们的价电子数之和为10。它们的最高价氧化物对应水化物之间,任意两种都能反应生成盐和水;Q元素与上述三种元素位于相邻的周期,Q原子的L电子层上有4个电子。
(1)试写出这些元素的元素符号X Y Z Q ;
(2)X、Y的最高价氧化物对应水化物反应的离子方程式为 ;
(3)X有常见的两种氧化物,它们均可以与Q的一种氧化物反应,得到的产物溶于水后,向其中加入Y与Z的最高价氧化物对应水化物反应的产物的现象是 ,产生这一现象的离子方程式为 。
(1)X为Na,Y为Al,Z为S,Q为C。
(2)OH-+ Al(OH)3= AlO2-+2H2O
(3)白色沉淀和有气泡产生,2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。
A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。单质C是一种黄绿色气体,A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种气体X,且X分子与B2A分子中的电子数相等。B与C可形成气体Y,且Y分子与最简式为BA的分子中的电子数相等。
请回答:
(1)写出DA2的化学式: ;写出最简式为BA的物质的电子式
(2)写出单质C与过量X反应的化学方程式
(3)写出B4A3D2的水溶液呈弱酸性的原因(用离子方程式表示)
(1)NO2
![]() (2)3Cl2+8NH3=N2+6NH4Cl
(2)3Cl2+8NH3=N2+6NH4Cl
(3)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+