高三化学第一次调研测试卷
化 学
| 题 号 | 1—16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 总分 |
| 满分值 | 48 | 6 | 6 | 6 | 4 | 8 | 10 | 6 | 6 | 100 |
| 实得分 |
可能用到的相对原子质量:H~1 Li~6.9 C~12 N~14 O~16 S~32 Fe~56 Cu~64
第Ⅰ卷(选择题共48分)
选择题(包括16小题,每小题3分,共48分)每小题只有一个选项符合题意。请将正确选项的序号填入Ⅱ卷卷首答题表的相应空格内。
1.钋(Po)是周期表中第84号元素,是居里夫人在1898年发现的。钋-210属极毒放射性核素。据报道,最近俄罗斯的前特工利特维年科的死亡与钋-210的毒害有关。对钋-210的叙述正确的是
A.钋是一种银白色金属,能在黑暗中发光
B.钋的原子核内有210个中子
C.钋-210原子中中子数与核外电子数之差为126
D.钋-210的摩尔质量为210g
2.我国将与德国合作,在近期启动钻探“可燃冰”的实物样品的工作,实现“可燃冰”钻探零的突破。“可燃冰”的主要成分是甲烷水合物[CH4•nH2O]晶体。有关甲烷水合物的说法正确的是
A.它属于原子晶体 B.它属于混合物
C.可燃冰可以燃烧说明水具有可燃性 D.甲烷水合物中H2O是极性分子,CH4是非极性分子
3.下列物质的水溶液,其pH小于7的是
A.Na2SO4 B.NH4Cl C.Na2CO3 D.KNO3
4.下列各组变化中,前者是物理变化,后者是化学变化的是
A.碘的升华、石油的分馏
B.用盐酸除金属表面的锈、食盐水导电
C.氢氧化铁胶体加热后凝聚、蓝色的胆矾常温下变白
D.热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫
5.下列有关说法正确的是
A.MgCl2、聚氯乙烯、HD均为化合物 B.C2H4O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质 D.SiO2、NaCl、S8、Cu均能表示物质分子组成
6.下列各组离子,在强酸性溶液中能大量共存的是
A.NO3-、Cl-、Na+、K+ B.Na+、Fe2+、Cl-、NO3-
C.K+、Na+、AlO2-、NO3- D.SO32-、Na+、K+、Cl-
7.下列叙述正确的是
A.在CCl4、PCl3、PCl5中各原子最外层均能达到8电子的稳定结构
B.M层电子为奇数的所有主族元素所在的族序数与该元素原子的M层电子数相等
C.13C与C60互为同素异形体
D.按C、N、O、F的顺序,元素的最高正价依次升高
8.下列离子方程式中,书写不正确的是
A.常温下,Cl2与NaOH溶液反应:Cl2+2OH-=C1-+C1O-+H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
9.NA为阿伏加德罗常数,下列说法中正确的是
A.22.4L氮气中所含原子数为2NA B.1mol Na2O2与水完全反应,转移电子数为NA
C.1L lmol·L-1 Na2CO3溶液中CO32-数为NA D.标准状况下,2mol SO3所占的体积约为44.8L
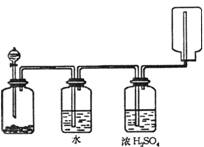 10.右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)
10.右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)
气体,该装置可用于
A.二氧化锰和双氧水反应生成氧气
B.浓氨水和生石灰混合生成氨气
C.Na2SO3和浓H2SO4混合生成SO2
D.锌粒与稀盐酸混合生成H2
11.在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡下列叙述正确的是
CH3COO-+H+,对于该平衡下列叙述正确的是
A.加入少量NaOH固体,平衡向正方向移动
B.加入少量CH3COONa固体,平衡向正方向移动
C.加入水时,平衡向逆方向移动
D.加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
12.用类推的方法可能会得出错误结论,因此类推出的结论要经过实践的检验才能确定其正确与否。下列类推结论中正确的是
A.Mg失火不能用CO2灭火,Na失火也不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,工业上也用电解熔融AlCl3的方法制取金属铝
C.Al与S直接化合可以得到A12s3,Fe与S直接化合也可以得到Fe2S
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
13.近两年,全国发生了多起氯气泄漏及爆炸事故,喷出的氯气造成了多人伤亡。作为消防干警在现场的下列处理方法和过程较合理的是
①及时转移疏散人群,向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用皂肥水打湿的口罩;⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③④⑥ C.①②⑤⑥ D.①③⑤⑦
14.下列做法不存在安全隐患的是
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.实验室做钠的实验时,余下的钠屑投入到废液缸中
C.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
D.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
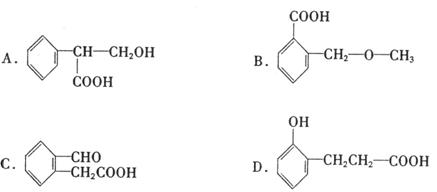
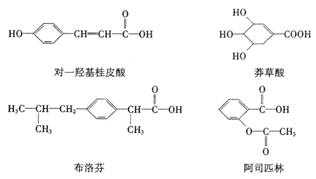 15.下列四种有机物是某些药物中的有效成分,对此四种有机物的有关说法正确的是
15.下列四种有机物是某些药物中的有效成分,对此四种有机物的有关说法正确的是
A.四种有机物都是芳香族化合物 B.四种有机物中,环上一氯代物都只有2种
C.四种有机物都能发生水解
D.等物质的量的四种有机物与NaOH溶液反应,阿司匹林消耗NaOH物质的量最多
16.1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.504mL B.168mL C.336mL D.224mL
第Ⅰ卷答题表
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 1l | 12 | 13 | 14 | 15 | 16 |
| 答案 |
 第Ⅱ卷(非选择题共 52分)
第Ⅱ卷(非选择题共 52分)
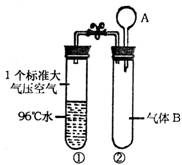
17.(6分)⑴(3分)如图所示,夹子开始时处于关闭状态,将滴管中液体A滴入试管②中,与气体B充分反应,打开夹子,可观察到试管①中96℃的水立即沸腾;则液体A和气体B的组合可能的是 。
A.氢氧化钠溶液;NO2气体
B.饱和食盐水;氯气
C.碳酸氢钠溶液;二氧化硫气体
D.氯化钙溶液;二氧化碳气体
⑵(3分)下列有关实验的叙述,不正确的是 。
A.白磷保存在水中,金属钠保存在煤油中,硝酸保存在棕色细口瓶中,且用磨口玻璃塞密封瓶口
B.用渗析法分离淀粉、KNO3
C.用氨水洗涤做过银镜反应的试管
D.用标准浓度的NaOH溶液测定未知浓度的盐酸,中和滴定前观察滴定管的液面高度为俯视,滴定终点时观察液面高度为仰视,测出的盐酸的浓度偏高
18.(6分)氧族元素单质与H2反应情况为:
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
⑴氧族元素形成的氢化物的稳定性由强到弱的顺序是: 。
⑵工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
( )A12Te3+( ) =( )Al(OH)3↓+( )H2Te↑
⑶在101kPa时,4.0g硫粉在氧气中完全燃烧生成SO2,放出37kJ的热量,则硫燃烧的
热化学方程式为 。
19.(6分)A、B、C、D、E为短周期的五种元素,它们原子序数依次递增,B是构成有机物的主要元素;A与C可形成10电子化合物W,它可使紫色石蕊试液变蓝;D元素的原子最外层电子数是其次外层电子数3倍;E是同周期元素中原子半径最大的元素;A、B、C、D可形成化合物X,在X晶体中阳离子与阴离子个数比为1∶1;A、D、E可形成化合物Y。A、C、D可形成离子化合物Z。
回答下列问题:
⑴Y的电子式: ;W的空间构型: ;
⑵写出Z的水溶液中各离子浓度由大到小的顺序: ;
⑶写出常温下X与足量的Y在溶液中反应的离子方程式: 。
20.(4分)南昌大学最近研发出一种新型纳米锂电池,已跻身国内领先地位。以下是某种锂离子电池反
![]() 应:C6Li+Li1-xMO2 C6Li1-x+LiMO2(C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)
应:C6Li+Li1-xMO2 C6Li1-x+LiMO2(C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)
回答:
⑴锂电池放电时的负极反应为:C6Li-xe-=C6Li1-x+xLi+,则正极反应为: ;
⑵电池放电时若转移1mol e-,消耗的负极材料 g。
21.(8分)已知B、D为常见金属单质,H常温下为无色液体,F为黑色晶体。根据下列框图所示,试回答:
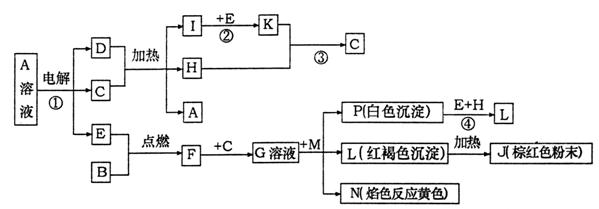
⑴写出化学式:H L ;
⑵反应①的离子方程式 ;
⑶反应②的发生,工业上采取常压操作,理由是 ,
对于反应③,工业上采取的操作不是使K直接与H反应,而是采用 ;
⑷写出反应④的化学反应方程式 。
22.(10分)由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率。根据下面金丝桃素的结构简式回答下列问题:
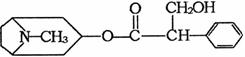
⑴金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结构简式:
B. ,该反应属于 反应。
⑵室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是 (填序号)
①浓H2SO4和HNO3的混合液 ②H2(催化剂加热) ③CH3CH2CH2CH3
④Na ⑤O2(催化剂加热) ⑥Na2CO3溶液
⑶写出两分子C与浓H2SO4共热,生成八元环状物的化学方程式:
。
⑷下列物质与C互为同分异构体的有 。
23.(6分)向一密闭容器中充入1mol A,2mol B,发生如下反应:A(g)+2B(g)![]() C(s)+3D(g)
C(s)+3D(g)
在一定条件下达到平衡,测得混合气体D的浓度为l.4mol/L;
⑴若压缩容器增大压强,则逆反应的速率 ;容器中D的浓度 ;(填“增大”、“减小”或“不变”)
⑵温度升高,混合气体平均相对分子质量增大,则正反应 ;(填“吸热”或“放热”)
 ⑶在一体积可变的密闭容器中,充入0.8mol C,3.5mol D,若使D的浓度仍为l.4mol/L,则容器体积取值范围为
。
⑶在一体积可变的密闭容器中,充入0.8mol C,3.5mol D,若使D的浓度仍为l.4mol/L,则容器体积取值范围为
。
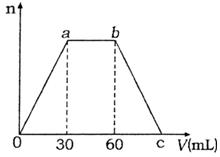
24.(6分)向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
⑴a点之前反应的离子方程式为
;
⑵c点的二氧化碳体积是 mL;
⑶混合稀溶液中Ca(OH)2和NaOH的物质的量之比
为 。
化学参考答案及评分意见
选择题(包括16小题,每小题3分。共48分)每小题只有一个选项符合题意。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | B | C | C | A | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | D | A | A | B | C | D | D |
非选择题(共52分)
17.(6分)⑴A(3分) ⑵C(3分)
18.(6分)⑴H2O>H2S>H2Se>H2Te(2分) ⑵l 6H2O 2 3 (2分)
⑶S(s)+O2(g)=SO2(g);△H=-296kJ/mol(2分)
19.(6分)⑴Na+[∶![]() ∶H]-(1分) 三角锥形(1分)
∶H]-(1分) 三角锥形(1分)
⑵c(NO3-)>c(NH4+)>c(H+)>c(OH-) (2分)
⑶NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O (2分)
20.(4分)⑴Lil-xMO2+xLi++xe-=LiMO2(2分) ⑵![]() (2分)
(2分)
21.(8分)⑴H2O (1分) Fe(OH)3(1分)
⑵2Cu2++2H2O![]() 2Cu↓+O2↑+4H+(2分)
2Cu↓+O2↑+4H+(2分)
⑶常压下SO2的转化率已经很高(1分);98.3%的浓硫酸吸收SO3(1分)
⑷4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
22.(10分)⑴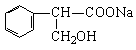 (2分) 水解(或取代)(1分)
(2分) 水解(或取代)(1分)
⑵③(2分)
⑶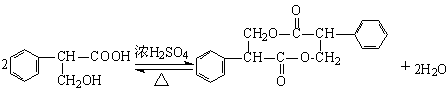 (3分)
(3分)
⑷BD(2分)
23.(6分)⑴加快(1分)增大(1分) ⑵放热(2分) ⑶2.5L>V>![]() L(2分)
L(2分)
24.(6分)⑴Ca2++2OH-+CO2=CaCO3↓+H2O (2分) ⑵90(2分) ⑶l∶l(2分)