高三化学第二轮复习专题强化训练7
无机推断
班级 姓名 座号 成绩
可能用到的相对原子质量:Fe:56 Al:27 C:12 H:1 O:16 Mg:24 P:31 K:39 Cu:64 Na:23
1.(10分)中学化学中有很多物质可以实现下图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。
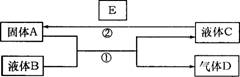 (1)若A是一种紫红色金属,气体D能
(1)若A是一种紫红色金属,气体D能
使品红溶液褪色,加热时又恢复原色。写出
反应①的化学方程式
该气体D与另一种气体H混合后生成一种淡黄色固体w,写出该反应的化学方程式
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液 (填“能”、“否”)。
(3)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。
写出反应①的离子方程式
写出反应②的任意一个离子方程式
2.(10分)钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”。
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志。我国至今产量不足,尚需进口二氧化钛。“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
(1)将钛铁矿与浓H2SO4煮解: FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O
(硫酸钛酰)
|
(3)煅烧TiO2·nH2O===TiO2+nH2O
“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
① ;
② 。
根据废液主要成分,针对其中一项污染,提出处理的方法。③
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究。
提出假设:a. Ti金属活动性比Mg强;b. Ti金属活动性比Cu弱。
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强。
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象。
①稀盐酸:放出H2速率 Mg>Ti,铜不反应。 ②稀HF:放出H2速率 Ti>Mg
根据上述 现象(填①或②)得出金属活动性Mg Ti。如何解释另一反常现象 。
3.(10分)中学化学中几种常见物质的转化关系如下:
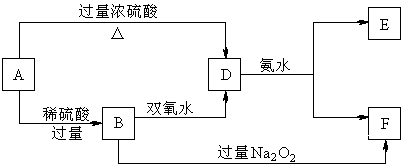
已知A→D的反应必须加热,否则会发生钝化现象。请回答下列问题:
(1)B、D、E的化学式依次为 、 、 。
(2)写出B的酸性溶液与双氧水反应的离子方程式: 。
(3)写出B和过量过氧化钠反应生成F的化学方程式
。
4.(10分)由短周期元素组成的10种物质A~J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
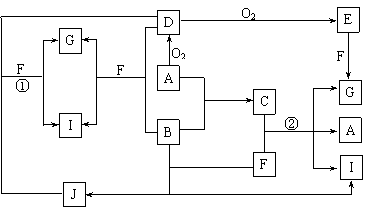 |
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
5.(10分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
(1)在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
| 时间 | 起始 | 14min后 | 30min后 | 75min后 |
| pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因________________________ __________
__ _如果把排气管加长一倍,排气的pH_________(回答“增大”“减小”或“不变化”),解释原因___________________________________________________________ _ ___
(2)上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这种物质是__________________,为什么此时会有沉淀析出________________________________________________ __
高三化学第二轮复习专题强化训练7参考答案
1.(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O(2分)2H2S+SO2=3S+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)2H2S+SO2=3S+2H2O(2分)
(2)否(2分)(3)3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O(2分)Cu2++Fe=Fe2++Cu(2分)(其余合理答案也得分)
2.(1)①废液呈强酸性,污染水体。
②因废液中含有Fe2+,4Fe2++O2+4H+=== 4Fe3++2H2O,消耗水体中的O2。
③Mn2+、Zn2+、Cr3+等种金属离子排入水体造成对水体重金属污染,使水体生物绝迹。
加入废铁屑或石灰或熟石灰。
(2)① > F- 会和钛形成氟钛络合物。
3.(1)FeSO4;Fe2(SO4)3;(NH4)2SO4 (各2分,共6分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O (2分)
(3)4Na2O2+6H2O+4FeSO4==4Fe(OH)3↓+4Na2SO4+O2↑(2分) 或写成
2FeSO4+H2SO4+3Na2O2+2H2O==2Fe(OH)3↓+3Na2SO4+O2↑(2分)
若反应分三步书写:2Na2O2+2H2O==4NaOH+O2↑;FeSO4+2NaOH==Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O==4Fe(OH)3 全部写正确,同样给分,其中有一个错误就不给分。其它合理的反应过程参照给分。
4.⑴接触室 ⑵HClO + SO2 + H2O = 3H+ + SO42— + Cl—
⑶SO2和H2 ⑷SO3(g)+ H2O(l)=H2SO4(l);△H=-130.3kJ/mol
⑸![]() (每空2分,共10分)
(每空2分,共10分)
5.(1)由于盐酸受热蒸发出HCl气体所致,随着反应的进行,盐酸逐渐与煤矸石中的物质反应而被消耗,因此,排气的pH从小逐渐变大。 增大。 如果排气管加长一倍,意味着排气被冷却的程度更高,HCl更多被冷凝回流,故排气的pH有所增大。
(2)沉淀物是水合硫酸钙(或硫酸钙)。由于硫酸钙是微溶的,在稀BAC溶液中达到饱和,浓缩蒸发过程中变为过饱和,故形成细晶状析出。 (每空2分)