高三化学第二学期无机框图题专项训练周练5
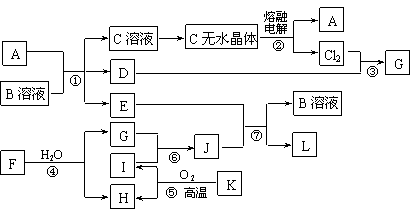
1.(10分)(2007南通一模)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
 |
请按要求填空:
⑴工业生产中,实现反应⑤的设备是 。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的 (填“字母”)。
⑶反应①的离子方程式为 ;
将J滴入沸水中的离子方程式为 。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
1.⑴沸腾炉
⑵G
⑶Mg+2NH4+=Mg2++H2↑+2NH3↑ Fe3++3H2O(沸)=Fe(OH)3(胶体)+3H+
⑷SOCl2 (每空2分,共10分)
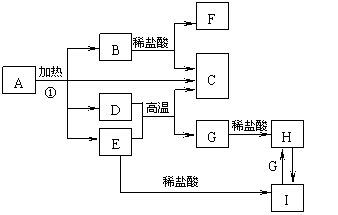 2.(扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
2.(扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
2
、(10分)(1)![]() (2分)
(2分)
(2)K3Fe(C2O4)3 (2分)
(3)3CO+Fe2O3===2Fe+3CO2(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3+与SCN—离子反应。(2分)
3.(2007年上海调研卷)
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
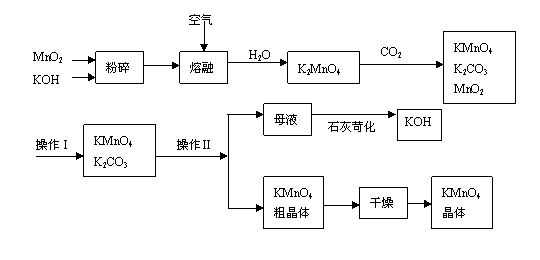
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
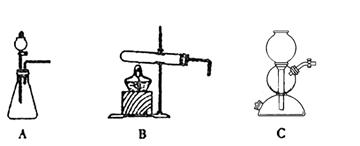
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
3.(12分)
(1)ab(2分);(2)d(1分);(3)MnO2;KOH(2分);(4)![]() (1分);
(1分);
(5)cd(2分);A(1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分)
4.(8分)(盐城市07二模)江苏省东部沿海有954 km的海岸线,合理开发和利用海洋资源对江苏经济发展意义重大。下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物
或生成物已略去)。已知:A是海水中的重要资源;C、D、F是单质,其中C、D在常温常压下是气体;反应②是化工生产中的重要反应,生成物E是84消毒液的有效成份;J、K均为不溶于水的物质,其中J为红褐色。
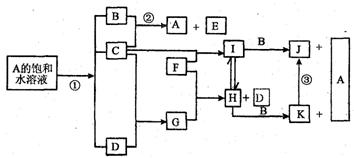 |
请按要求填空:
(1)反应①的离子方程式(请注明反应条件) 。
(2)B的电子式____;E的化学式____。
(3)③的化学方程式 。
(4)D被誉为很有发展前途的未来燃料。你所了解的实现该目标尚存在的实际问题有
(列举一条)。
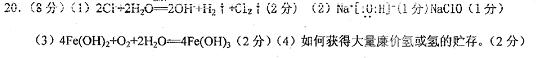
5.(8分) (常州市2006—2007学年高三第一学期期末调研). 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
 ⑴X的化学式为________________;
⑴X的化学式为________________;
⑵写出反应①、②的离子方程式:
① 。
② 。
⑶用电子式表示G的形成过程:
_________________________________________ 。
5.(8分)⑴NaOH(每空2分,方程式不配平不给分,条件不写扣1分)
⑵①2Al3++6Cl-+6H2O![]() 3H2↑+3Cl2↑+2Al(OH)3↓
3H2↑+3Cl2↑+2Al(OH)3↓
②Al3++3AlO2-+6H2O=4Al(OH)3↓
⑶![]()
6.(10分)(2006~2007学年第一学期期末调研考试高三化学试题)由短周期元素组成的10种物质A~J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
 |
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
6.⑴接触室 ⑵HClO + SO2 + H2O = 3H+ + SO42— + Cl—
⑶SO2和H2 ⑷SO3(g)+ H2O(l)=H2SO4(l);△H=-130.3kJ/mol
⑸![]() (每空2分,共10分)
(每空2分,共10分)
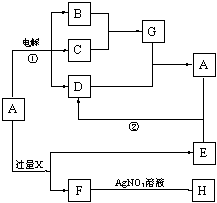
7.(10分)(07南通市九校联考)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。其中反应②用于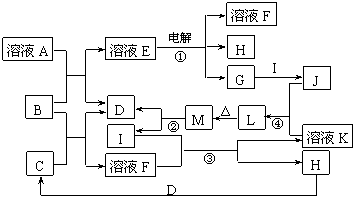 常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
试回答下列问题:
⑴溶液A为 (写名称),B的电子式 。
⑵反应①的离子方程式 ;
反应③的离子方程式 。
⑶有同学认为M也可由溶液J、溶液K各自加热灼烧获得,试判断这种说法是否正确?
(填“是”或“否”),理由是 。
7.(10分)盐酸(1分) ![]() (2分)
(2分)
2Cl―+2H2O![]() Cl2↑+H2↑+2OH-(2分)
Cl2↑+H2↑+2OH-(2分)
2Al+2H2O+2OH-=2AlO2-+3H2↑(2分)
否(1分)
AlCl3、NaAlO2溶液加热蒸干、灼烧,前者获得Al2O3、后者得到的仍是NaAlO2(2分)
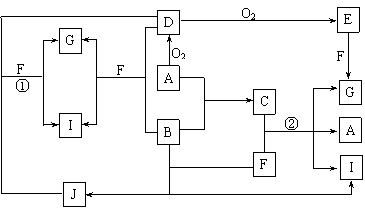
8.(10分)物质A~K的转化关系如下图所示,已知A是由两种元素组成的化合物;B是非金属单质;J是金属单质。H的相对分子质量比D大16(部分反应物、生成物未列出)。
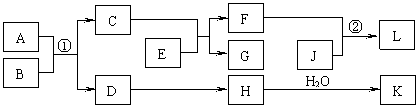
依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应。
⑴ G的电子式是__________。
⑵ 工业上反应①在 (填工业设备名称)中进行。
⑶ 反应①的化学方程式为 。
Ⅱ. 若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同。
⑷ 物质A的分子式是____________。
⑸ 反应②的离子方程式为____________________________________________。
8.(1) (2) 沸腾炉
(3)4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(4) NH3 (5) 2Al+2OH-+2H2O=2AlO2-+3H2↑ (本题共10分,每空2分)