高三化学第二次联合模拟考试
理 综 试 题 (化学部分)
相对原子质量(原子量):H:1 C:12 N:14 O:16
一、选择题(每小题只有一个选项符合题意。每小题6分)
6.美国和俄罗斯科学家将大量48Ca离子加速去轰击人造元素249Cf,从而制造出3颗新原子。
每颗新原子的原子核包含118个质子和179个中子。下列有关该元素的叙述正确的是
( )
A.该元素的相对原子质量为297
B.这是—种金属元素
C.这是—种在元素周期表中序号为118的新元素
D.在自然界中也存在该元素,只是还没有发现
7.下列说法不正确的是 ( )
A.在医疗上,碳酸氢钠是治疗胃酸过多症的一种药剂
B.工业上生产漂粉精,是通过氯气与石灰水作用制成的
C.高性能通信材料光导纤维的主要原料是二氧化硅
D.空气中的NO2是造成光化学烟雾的主要因素
8.A、B两种有机物不论以何种比例混合,只要混合物总质量不变,完全燃烧时生成H2O的
量也不变。则A、B的组合不可能是 ( )
A.C10H8和C6H8O3, B.C2H2和C6H6
C.C2H4和C3H6 D.CH4和C2H4
9.向一定量的明矾溶液中滴加Ba(OH)2溶液,生成沉淀的质量m与加入Ba(OH)2溶液
的体积V 之间的关系正确的是 ( )
|
|
A.该溶液由pH=3的CH3COOH溶液与pH=1l的NaOH溶液等体积混合而成
B.该溶液由0.2mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
C.该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成
D.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
11.下列离子方程式正确的是 ( )
A.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42—=BaSO4↓
B.碳酸氢钠溶液与少量石灰水反应:2HCO3—+Ca2++2OH—=CaCO3↓+CO32-+2H2O
C.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O![]() A1O2—+4NH4++2H2O
A1O2—+4NH4++2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4+OH—=NH3↑+2H2O
12.FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3mol的电子转移,则参加反应的硝酸中未被还原的硝酸的物质的量为 ( )
A.0.9 mol B.0.45 mol C.0.3 mol D.0.1 mol
13.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g);△H<O。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡.与原平衡的比较,正确的是 ( )
2Z(g);△H<O。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡.与原平衡的比较,正确的是 ( )
|
| 新平衡和原平衡比较 | |||
| A | 升高温度 | X的体积分数变大 | ||
| B | 增大压强 | Z的浓度不变 | ||
| C | 减小压强 | Y的体积分数变大 | ||
| D | 充入一定量Z | X的体积分数变大 |
非选择题
26.(13分)氧族元素的各种性质可归纳整理出如下图所示的表格(部分):
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点热易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
回答下列问题:
|
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式 。
(3)碲的主要化合价可能有 。
 (4)工业上可用Al2Te3制备H2Te,化学方程式
(4)工业上可用Al2Te3制备H2Te,化学方程式
为 。
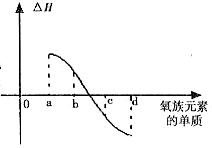
(5)右图所示为上述氧族元素单质与H2反应过
程中的能量变化示意图,其中a、b、c、d
分别表示氧族中某一元素的单质,△H为
相同物质的量的单质与H2反应过程中的
能量变化(反应的热效应)。则:b代
表 ,d代表 (写化学式)。
|
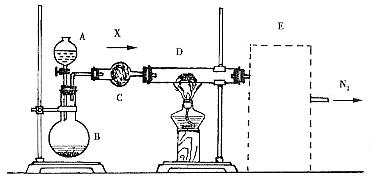
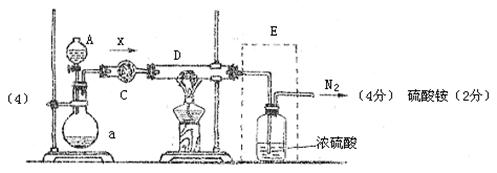
装置A、B、C、E中的药品从下列范围中选择:
浓硫酸、稀硫酸、浓硝酸、稀硝酸、浓盐酸、稀盐酸、浓氨水、浓NaOH溶液、铜片、
锌片、碱石灰、硫酸铜、生石灰、氯化铵晶体。
回答下列问题:
(1)C装置内的药品是 ,作用是 。
(2)写出A中溶液和B中固体的所有组合 。
(3)纯净X通过D时反应的化学方程式是 ,表明X具
有 (填“氧化性”或“还原性”)。
(4)请在图中的虚线框内画出装置E(要求与两侧导管衔接),并标明其中所盛试剂。在该装置中产生的新物质的名称是 。
28.(15分)已知A、B、C、D、E是常见的气体,F是固体,同温同压下等体积D的质量比E的质量的2倍略大,它们之间存在如下的转化关系:
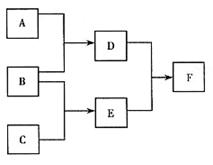
(1)请写出F中所含化学键的名称 。
(2)用电子式表示C的形成过程 。
(3)写出与D电子数相等的两种单质的分子式 。
(4)在标准状况下,若1体积水中溶解378体积的E气体,所得溶液的密度为0.915g·cm-3,
则溶液的物质的量浓度为 (保留两位有效数字)。
29.(14分)苹果酸是由苹果发酵得到的酸性物质。将苹果酸分离提纯后进行化学分析,得
如下结果:
①相对分子质量不超过250,完全燃烧后只生成CO2和H2O,分子中碳的质量分数为
35.82%、氢的质量分数为4.48%;
②0.1mol该酸与足量的NaHCO3反应放出4.48L CO2,与足量的钠反应放出3.36L H2(气体体积均已折算为标准状况下的体积);
③该分子中存在四种化学环境不同的碳原子。
请回答下列问题:
(1)该酸的分子式为 ,结构简式为 。
(2)写出该酸在一定条件下,每两个分子发生分子间脱水生成所有环酯的结构简式:
。
苹果酸可以发生如下一些变化:
苹果酸![]() 富马酸
富马酸![]() 杀菌剂:富马酸二甲酯(C6H8O4)
杀菌剂:富马酸二甲酯(C6H8O4)
(3)写出富马酸分子中所含官能团的名称 。
(4)写出生成富马酸二甲酯的化学方程式 。
参考答案
6.C 7.B 8.D 9.C 10.B 11.B 12.C
|
26.(13分)
(1)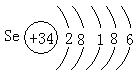 (2分)
(2分)
(2)Cl2+H2O2=2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O=2Al(OH)3↓+3H2Te↑(或其它合理答案(3分)
(5)Se(2分)O2(2分)
27.(18分)(1)碱石灰(或其它合理答案)(2分)、干燥氨(1分)
(2)浓氨水和碱石灰、浓氨水和生石灰、浓氢氧化钠溶液和氯化铵晶体(各2分)
(3)2NH3+3Cu![]() 3Cu+N2+3H2O(2分)、还原性(1分)
3Cu+N2+3H2O(2分)、还原性(1分)
|
28.(15分)(1)离子键、共价键(或其它合理答案)(2分)
(2)![]()
(3)F2、Ar(各2分)
(4)12mol/L(4分,不写单位扣1分)
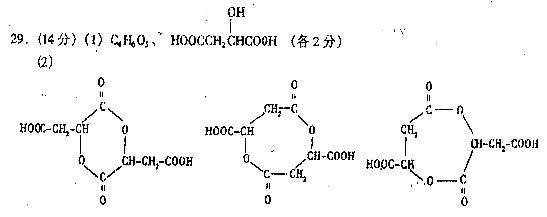
(各2分)
(3)碳碳双键、羧基(各1分)
(4)HOOCCH=CHCOOH+2CH3OH![]() CH3COOH=CHCOOCH3+2H2O(2分)
CH3COOH=CHCOOCH3+2H2O(2分)