高三化学第一次调研考试试题
化 学 试 题
(命题人:陆蓁 审题人:孙运利 韩程明)
考生注意 :
1. 本试题分试题卷和答题卡两部分。试题为六大题26 小题。满分150 分。考试时间120分钟。
2. 答题前,考生务必将自己的姓名、考试号等填写在答题卡的指定位置。所有试题答案直接
写在答题卡上规定位置。考试结束,考生只交答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
Si-28 S-32 C1—35.5 Ca-40 Fe—56 Ba-137
—、单项选择题(本题包括8 小题,每小题4 分,共32 分. 每小题只有一个选项符合题意)
1. 居室装修用石材的放射性常用226 88Ra(镭)作为标准. 居里夫人(Marie Curie) 因对Ra 元素
的研究两度获得诺贝尔奖。下列叙述中正确的是
A. —个226 88Ra 原子中含有 138 个中子 B.Ra 元素位于元素周期表中第六周期II A 族
C.RaCl2 的熔点比CaCl2 高 D.Ra(OH)2 是一种两性氢氧化物
2. 航天员专用水必须是健康的,必须保存原水中对人体有益的矿物质和微量元素,选pH 呈
弱碱性,小分子团的健康水。由解放军总装备部军事医学研究所研制的小分子团水,具有饮
用量少,渗透力强,生物利用度高、在人体内储留时间长、排放量少的特点。一次饮用 125mL 小分子团水,可维持人体6 小时正常需水量。 下列关于小分子团水的说法正确的是
A. 水分子的化学性质改变 B.水分子中的化学键改变
C.水分子由极性分子变为非极性分子 D.水分子间结构、物理性质改变
3. 根据下列事实,判断离子的氧化性顺序为
①A+B2+ =A2++B , ②D +2H2O=D(OH)2 + H2↑, ③ 以B、E为电极与E的盐溶液
组成原电池,电极反应为:E2++2e-=E ,B—2e-=B2+
A.E2+>B2+>A2+>D2+ B.D2+>E2+>A2+>B2+
C.D2+>B2+>A2+>E2+ D.A2+>B2+>D2+>E2+
4. 在室温下,将pH=3 的酸和pH=11 的碱等体积混合,混合后溶液的pH 小于7 。
则该酸和碱的组合可以是
A.硝酸和氢氧化钡 B.盐酸和氨水
C. 硫酸和氢氧化钾 D.醋酸和氢氧化钠
5. 以下除杂方法(括号内为少量杂质) 中,错误的是
A.Fe(OH)3 胶体(FeCl3溶液) :蒸馏水,渗析
B.KCl (I2 ) 固体: 加热,升华
C. NaC1 (KNO3 ) :配成饱和溶液,降温结晶
D.CO2 (SO2 ) : 通过饱和NaHCO3溶液、浓硫酸
6. 阿伏加德罗常数约为6.02 × 1023mol-' ,以下叙述正确的是
A.1mol 任何气体单质在标况下体积都约为22.4L,含有的原子数都为2×6.02×1023
B.同温、同压、同体积的氢气和氧气具有相同的分子数
C. 在铁与硫的反应中,1mol 铁失去的电子数为3×6.02×1023
D.在pH=13 的 NaOH 溶液中,OH- 的数目为0.1×6.02×1023
7. 下列实际应用与盐的水解知识无关的是
A.焊接时用 NH4C1 溶液除锈
B. 使用泡沫灭火器时,使硫酸铝与饱和小苏打溶液混合
C. 饱和氯化铁溶液滴入沸水制备 Fe(OH)3 胶体
D.生活中用电解食盐水的方法制取消毒液
8. 下图是从NaCl 或CsCl 晶体结构图中分割出来的部分结构图,其中属于从NaCl 晶体中分割出来的结构图是
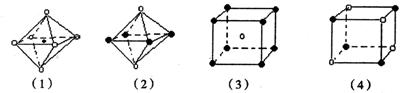
A.图(1)和图(3) B.图(2)和图(3) C. 图(1)和图(4) D.只有图(4)
二、不定项选择题(本题包括8 小题,每小趣4 分,共32 分。 每小题有一个或两个选项符合
题意。 若正确答案只包括一个选项,多选时,该题为0 分;若正确答案包拾两个选项,只选1 个且正确的给2 分,选两个且都正确的给满分,但只要选错一个该小题就为0 分)
9. 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20~50MPa的
高压和500℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。
最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2 的新催化剂,
在常温下合成氨,反应方程式可表示为N2 +3H2![]() 2NH3
. 有关说法正确的是
2NH3
. 有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C. 新法合成氨能在常温下进行是因为不需要断裂化学键
D. 新催化剂降低了反应所需要的能量,提高了活化分子百分数
10. 下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H =—216kJ·mol-1 ,
反应物总能量>生成物总能量
B.CaCO3 ( s) = CaO(s) +CO2 (g) ;△H = + 178. 5 kJ·mol-1
反应物总能量>生成物总能量
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H =—571. 6 kJ·mol-1 ,
H2的燃烧热为571.6 kJ·mol'
D.H+ (aq) +OH-(aq) =H2O(l) ;△H=—57.3 kJ·mol-' ,含 1molNaOH 的氢氧化钠
溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
11. 以下离子检验的结论可靠的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B. 通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I-
C. 往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32—
D.往溶液中加入 BaC12 溶液和稀 HNO3 ,有白色沉淀生成,说明有SO42-
12. 某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng
水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
13. 下列反应的离子方程式书写正确的是
A. 过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
B. 次氯酸钙溶液中通入过量CO2 :ClO-+CO2 + H2O=HClO+HCO3-
. C. 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
D.1mo·L-1 的 NaAlO2 溶液和2.5mol· L-1 的盐酸等体积混合:
2AlO2- + 5 H+=Al(OH)3 ↓+ Al3+ + H2 O
14. 某溶液中大量存在五种离子:NO3- 、SO42-、Fe3+ 、H+ 、X ,其物质的量之比为:
n(NO3-) :n(SO42-) :n(Fe3+) :n(H+) :n (X) = 2 :3 :1 :3 :1,则X 可能为
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
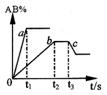 15. 右图是反应A2 +B2
15. 右图是反应A2 +B2![]() 2AB
在不同温度和压强下,AB体积
2AB
在不同温度和压强下,AB体积
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中:最少有一种为非气体,正反应吸热
D.AB 为固体,A2 、B2 中最少有一种为气体,正反应吸热
16. 镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。镍氢电池
的总反应式是:H2+2NiO(OH)![]() 2Ni(OH)2 ,根据此反应判断,下列叙述中正确的是
2Ni(OH)2 ,根据此反应判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的pH 不断增大
B.电池充电时,阳极反应为:Ni(OH)2 + OH- - e-= NiO(OH) +H2O
C.电池充电时,氢元素被还原
D.电池放电时,负极反应为:H2-2e-=2H+
三、(本题包括4 小题,共27 分)
17. ( 7 分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。
这类材料中研究较多的是化合物G。
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。
请推断:G 和E的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业
上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀
的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃
时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:
赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________
18. ( 7 分)将a mol 铜加入到一定浓度的硝酸溶液中,充分反应后,铜完全溶解并产生气
体(不考虑N2 O4 ) 。试回答下列问题:
(1) 硝酸在该反应中表现的性质为_______________________
(2) 当a=0.3 时,则反应中转移的电子数为________mol,若此时收集到的气体在标准状况
下的体积为8.96L,则该气体为__________________。
(3) 用NH3吸收硝酸生产中产生的尾气是一种较为先进的吸收方法,其产物对环境无污染,
目前在工业生产以及汽车尾气处理中已被广泛应用。试写出用NH3恰好吸收(2)所产生气体
的总化学方程式______________________________
19. (6 分)在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。
请回答下列问题。
(1)在实验过程中水的电离程度的变化趋势是先_______后________;
(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和
溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
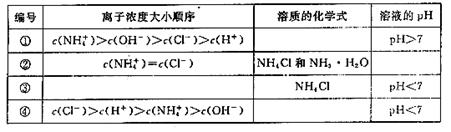
20. (7 分)
在一定温度下,向一个容积不变的容器中,通入3mol SO2 和2mol O2 及固体催化剂,使之反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6KJ·mol-1。平衡时容器内
2SO3(g);△H=-196.6KJ·mol-1。平衡时容器内
气体压强为起使时的90%。
Ⅰ. 加入3mol SO2 和2mol O2 发生反应,达到平衡时放出的热量为 ____________
Ⅱ. 保持同一反应温度,在相同容器中,将起始物质的量改为 a mol SO2 、 b mol O2 、
c mol SO3 (g) ,欲使平衡时SO3的体积分数为2/9。
⑴达到平衡时,Ⅰ和Ⅱ放出的热量 ______(填序号)
A.—定相等 B.前者一定小 C. 前者大于或等于后者
(2) a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)________________
⑶ 欲使起始反应表现为向正反应方向进行,a 的取值范围是____________________
四、(本题包括2 小题,共19 分)
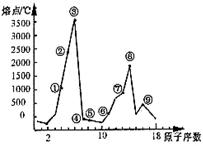 21.(9 分)右图是部分短周期元素的单质熔点的变化图,
21.(9 分)右图是部分短周期元素的单质熔点的变化图,
根据此图,填写下列空格:
(1) ③号元素位于周期表第____周期第_____族,
其单质的一种同素异形体能导电,该同素异形
体的名称叫________
⑵ ④号元素形成的气态氢化物的电子式为__________,
属于_____分子(填极性或非极性)
⑶ ⑥、⑦两种元素形成的最高价氧化物对应的水
化物之间相互反应的离子方程式为_____________________________
⑷ ⑨号元素的原子结构示意图为_______________________。
⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,
它对环境的危害主要是:_____________________________________________
22. (10 分) 已知:A、B 是两种盐的溶液,其焰色反应均呈黄色,A 呈中性,B呈碱性并具有氧化性;D 在CCl4中呈紫红色。下图为相关实验步骤和实验现象
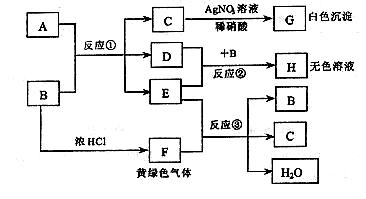
请回答:
(1) 依次写出 A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________
五、(本题包括2 小题,共22 分)
23. (11 分)为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同
们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,
充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序
为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的
先后顺序全部写出)_______________________________________________________
另一电极所发生的电极反应为_____________________________
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,
主要表现为: ____________________________________________________
24. (11 分)某校化学兴趣小组为测定混合物各组分的质量比,实验过程中所加试剂和
操作涉骤如下表所示(各步操作中,反应均完全)。
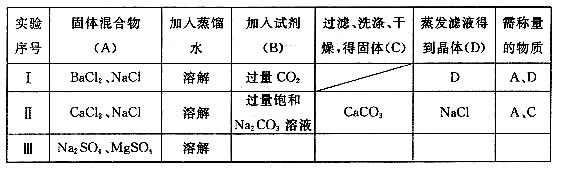
试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到
A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________, 其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________
六、(本题包括2小题,共18分)
25.(8分)《环境空气质量标准》中,有害气体的浓度常用标准状况下,每立方米气体中含有害气体的毫克值(mg/m3)来表示,对CO的浓度限值规定为:
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
① 首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2
(不考虑其他气体的反应);
② 用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,
发生的反应为:I2+2S2O32-=2I-+S4O62-
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1
的标准碘溶液进行滴定,滴定至终点,实验记录如下:
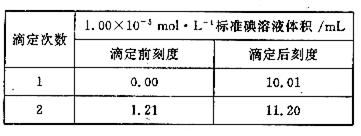 |
(1) 写出中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。
26. (10 分) 向物质的量之和为0.1mol 的FeCl3和AlCl3混合溶液中加入90mL4mol· L-1的
NaOH 溶液,使其充分反应。 假设原溶液中Al3+ 物质的量与Al3+ 和Fe3+ 总物质
的量之比为x,(不考虑Fe3+ 和Al3+的水解情况) 。
问:
(1)当x=0.8 时,溶液中产生的沉淀是什么?其物质的量为多少?
(2) 当沉淀只有 Fe(OH)3 时,计算x的取值范围.
(3)请在图中画出沉淀总量 n/mol 随 x (0~1)变化的曲线
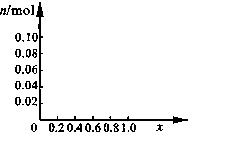 |
高三第一次调研考试
化学试题参考答案
一、二、 选择
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | A | D | C | B | D | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | BD | A | B | AD | BD | B | C | BC |
三、
17、(1) Si3N4 SiCl4 (2) Si3N4+3O2=3SiO2+2N2 (3) +4 -3 原子晶体
18、(1)氧化性、酸性 (2) 0.6 NO、 NO2 (3) 3NO+9NO2+14NH3=13N2+21H2O
19、 (1) 增大 减小 (2) ①NH3·H2O和NH4Cl ②pH=7
③c(Cl-)>c(NH4+)>c(H+)>c(OH-) ④ HCl 和 NH4Cl
20、Ⅰ 98.3KJ Ⅱ ⑴ C ⑵a+c=3 2b+c=4 ⑶ 2<a≤3
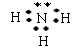 四、
四、
21、⑴ 二 ⅣA 石墨 ⑵ 极性
⑶Al(OH)3+OH-=AlO2-+2H2O ⑷ 形成酸雨等
22、 ⑴ NaI NaClO
⑵ 2I-+ClO-+H2O=I2+Cl-+2OH— I2+5ClO-+2OH_=2IO3-+5Cl-+H2O
⑶ Cl2+2NaOH=NaClO+NaCl+H2O
五、
23、方案1:Fe3+>Cu2+>H+>Fe2+ 漏斗、烧杯、玻璃棒
方案2: 阴 2Fe3++2e-=2Fe2+; Cu2++2e-=Cu ;
2H++2e-=H2↑; 2Cl--2e-=Cl2↑
①有污染性气体Cl2 产生 ② 使用了电解装置,成本较高;等。
24. ⑴BaCl2、NaCl
⑵D D中不仅含有NaCl,还有Na2CO3
⑶过量NaOH溶液(等合理答案) Mg(OH)2 Na2SO4 和 NaOH A 、C
(A-(120C/58)):(120C/58)
六、
25、⑴5CO + I2O5![]() 5CO2+I2
5CO2+I2
⑵ 3.85mg/m3 ,符合一、二级标准
26、⑴ Fe(OH)3 0.02 mol Al(OH)3 0.02 mol
⑵ 0<x≤0.6
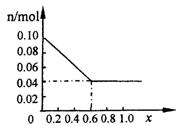 |
⑶