高三化学第三次教学质量检测
理科综合 化学试题
6.下列说法不正确的是( )
①一种元素只有一种原子,但可能有多种离子;②阴离子或阳离子有可能既有氧化性也有还原性;③由同种元素组成的物质属于单质;④有新单质生成的化学反应不一定是氧化还原反应;⑤具有相同质子数的粒子都属于同种元素。
A.①③⑤ B.①②③ C.③④⑤ D.①③④
7.下列判断正确的是( )
A.任何液溶胶加入可溶性电解质后都能使胶体粒子凝成较大颗粒形成沉淀析出
B.丁达尔现象、布朗运动、电泳现、胶体凝聚中都只涉及到分散系的物理性质
C.因为胶体粒子比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
D.胶体与其它分散系的本质区别是分散质粒子直径在1nm--100nm之间
8.下列混合物在物质的量一定时,组内各物质按任意比例混合,完全燃烧时消耗O2的量不变的是( )
A.甲烷、乙烯、甲醇 B. 乙烯、乙醇、羟基丙酸
C.乙炔、苯、苯乙烯 D. 丙烯、2-丁烯、丁醛
9. 下列说法正确的是( )
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大量存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性
10.下列各组离子,一定能在指定溶液中大量共存的是( )
A.使甲基橙变红的溶液中:Fe3+、Na+、NO3-、SO42-
B.水电离出的c(H+)=10-12mol/L的溶液中:NH4+、Na+、NO3-、S2O32-
C.加入碳酸氢铵能放出气体的溶液中:K+、Ca2+、I-、NO3-
D.能使紫色石蕊试液变蓝的溶液中:Na+、Mg2+、Cl-、SO42-
11.以氢氧化钾溶液、氢气、氧气组成的燃料电池,电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗mg气体时,电解池阴极有mg气体生成
B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑
C.电解后,c(Na2SO4)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
12.无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向
溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是( )
①肯定有BaCl2;②肯定有MgCl2;③肯定有NaHCO3;④肯定有Na2CO3或NaHCO3⑤肯定没有MgCl2
A.①②③ B.②④ C.①③ D.①③⑤
13.有硫酸镁溶液500mL,它的密度是1.20g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法正确的是( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4mol/L
C.溶质和溶剂的物质的量比是1:40
D.硫酸根离子的质量分数是19.2%
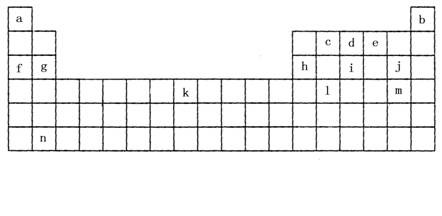
26.(17分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号) ;元素i的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)k位于元素周期表中第 族,写出该元素的单质在高温下与水蒸气反应的化学方程式 。
(3)已知与f在同一周期的元素R位于第p主族,则R的原子序数为(用p的代数式表示) ,R能形成气态氢化物,其氢化物的化学式为 。
(4)W、X、Y、Z为表中所列的四种元素,其原子序数X﹥W﹥Z﹥Y,X原子最外层电子数是其内层电子之和的1/5,Y原子最外层电子数是次外层电子数的2倍,W原子和Z原子可形成或2 : 1和1 : 1两种离子化合物。
①四种元素原子的半径由大到小的顺序为(填元素符号)
②写出两个由Y Z2参加的氧化还原反应方程式,其它反应物由上面四种元素的一种或几种组成
。
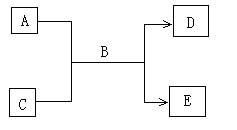 27.(14分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
27.(14分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E﹥D,则:
该反应的反应方程式为 ,
检验D中阴离子的方法是 。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行。写出反应的离子方程式 ;
。
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种) 、 。
写出生成E的一个离子方程式 。
28、(14分)现有分子式为C9H9O2X的物质甲(X为卤族元素),在一定条件下有如下的转化关系,其中E可作为工业上的增塑剂。
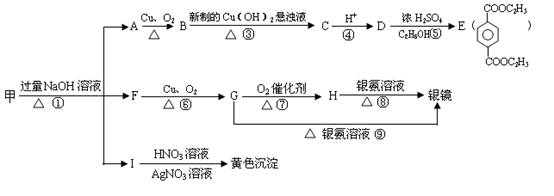
(1)写出下列物质的结构简式:甲 A 。
(2)上述反应中,属于氧化反应的有(填序号,下同) ,属于取代反应的有 。
(3)写出D的同分异构体的结构简式,该同分异构体苯环上的一氯代物有2种
(4)写出下列反应的化学方程式:
B→C ,
F→G 。
29、(15分)某同学设计了如右图装置,以便于准确观察铜片与稀硝酸反应的现象。c为止水夹,a、b为耐酸的多孔胶塞片(厚度1--2mm,高度可以调整),实验过程中可以选用的试剂:铜片、稀硝酸、块状CaCO3.回答下列问题:
(1)写出Cu与稀HNO3反应的离子方程式 。
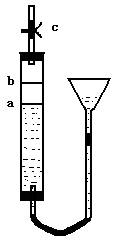 (2)适量的大理石放在
片上(填“a” 或“b”,下同),其作用是
。
(2)适量的大理石放在
片上(填“a” 或“b”,下同),其作用是
。
(3)欲使反应现象更为明显,则加入的铜片为 。
a.粗铜片 b。纯铜片
(4)实验操作步骤:①装好药品,打开止水夹c;②升高漏斗位置,让a片上的物质与稀硝酸接触;③充分反应后,再向漏斗中加入足量的稀硝酸至淹没b片上物质,并立即关闭止水夹c。
立即关闭止水夹c的原因是:① , ② 。
(5)实验中,可以观察到铜片与稀硝酸反应的现象为:
① ,② ,
③ ,④ 。
参考答案:
6、A 7、D 8、B 9、D 10、 A 11、D 12、C 13、 C
26、(17分)(1) He、Mg (2分);Cl2O7, H3PO4或 HPO3 (2分); 。
(2)Ⅷ (1分); 3Fe+4H2O(g)![]() Fe3O4+4H2(2分)。
Fe3O4+4H2(2分)。
(3) 10+p(2分); H8-pR或RH8-p(2分)
![]() (4)①Na﹥Mg﹥C﹥O (2分)
(4)①Na﹥Mg﹥C﹥O (2分) ![]() ②2Mg + CO2 2MgO + C
②2Mg + CO2 2MgO + C
2Na2O2 + 2CO2 = 2Na2CO3 + O2(4分、其它答案合理也给分)
27、(14分)(1)Cl2+SO2+2H2O=H2SO4+2HCl (2分);
先加硝酸酸化无沉淀,再滴加AgNO3溶液有白色沉淀生成,则含Cl-(2分)。
(2)2Al+6H+=2Al3++3H2↑ 2Al+2OH-+H2O=2AlO+H2↑(4分)
(3)H2SiO3 、Al ( OH )3(4分)
SiO32-+CO2+H2O=CO32-+H2SiO3↓或
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(2分)(其它答案合理也给分)
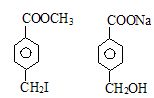
28、(14分)(1)(4分)
(2)②③⑥⑦⑧⑨(2分),①⑤(2分)
![]() (2分)
(2分)
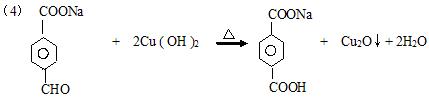
![]() (4分)
(4分)
29、(15分)(1)3Cu+8H++2NO3-= 3Cu2++2NO↑+4H2O (3分)
(2)a(2分) 利用开始产生的CO2赶走装置中的空气,防止空气中的氧气氧化后面生成的NO(2分)
(3)A(2分) (4)①防止空气进入氧化NO,生成红棕色的NO2 干扰对NO的观察; ②防止NO污染环境(2分)
(5)①溶液有无色变成蓝色; ②铜片溶解;③铜片上产生无色气泡; ④溶液液面下降;(4分)