高三化学第三次模拟考试试题
化 学 试 题
注:本试卷分Ⅰ卷和Ⅱ卷两部分,请将Ⅰ卷答案填涂在答题卡上,Ⅱ卷答案填写在答题框内。
相对原子质量:H-1 C-12 O-16 Na-23 S-32 K-39 Cu-64
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.神舟六号宇宙飞船发射成功,完成中国真正意义上有人参与的空间科学实验,标志着中国人的太空时代又前进了一大步。火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,关于该涂料的性质描述中最有可能的是
A.在高温下不熔化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能分解
2.纳米技术广泛应用于催化及军事科学中,纳米材料是指粒子直径在几纳米到几十纳米的材料。如将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是(1纳米=10-9米)
A.能全部透过半透膜; B.有丁达尔现象;
C.所得溶液一定能导电; D.所得物质一定为悬浊液或乳浊液。
3.在高能加速器中,将7030Zn撞入一个20882Pb的原子核并释放出一个中子后,合成一种人造重元素的原子。该元素原子核内中子数为
A.165 B.166 C.277 D.278
4.关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.离子晶体中,只存在离子键
D.分子晶体中一定存在共价键
5.在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与BaCl2溶液的体积比是
A.10:1 B.1:10 C.9:1 D.1:9
6.从矿物学资料查得,一定条件下自然界存在如下反应:
![]() ,下列说法正确的是
,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物
B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的![]() 离子有一部分是氧化产物
离子有一部分是氧化产物
D. FeS2只作还原剂
7.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(KJ·mol-1)Si—O:460、Si—Si:175、O=O:498,则反应:Si + O2 = SiO2的反应热△H为
A.-992 KJ·mol-1 B.-247 KJ·mol-1
C.-236 KJ·mol-1 D.+236 KJ·mol-1
8.联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
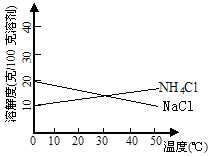
| 通入气体 | 温度控制 | |
| (A) (B) (C) (D) | CO2 CO2 NH3 NH3 | 30~40℃ 0~10 ℃ 30~40 ℃ 0~10℃ |
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列离子方程式书写正确的是
A.Na2CO3饱和溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3-
B.NaxB溶液水解:Bx-+xH2O![]() HxB +xOH-
HxB +xOH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
10. 设NA表示阿伏加德罗常数,下列有关说法正确的是
A.1 mol HNO3见光分解,转移电子数4NA
B. 28 g乙烯与28 g丙烯中均含有6NA对共用电子对
C.合成氨反应中,当断裂 3NA个H-H键的同时生成 6NA个N-H键,则该反应达到平衡状态
D.7.8 g Na2O2含有的阴离子数目为0.2 NA
11.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中![]() =1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(A-)>c(B+)>c(H+)>c(OH-)
12.对复杂的有机物物可用“键线式”表示,如苯丙烯酸-1-丙烯酯
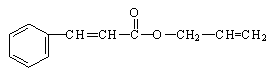 可简化为:
可简化为: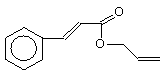 ,
,
杀虫剂“阿乐丹”的结构表示为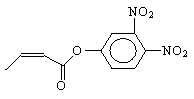 ,若它在稀酸作用下能发生水解反应,生成两种有机物,则此两种有机物具有的共同性质是
,若它在稀酸作用下能发生水解反应,生成两种有机物,则此两种有机物具有的共同性质是
A.遇FeCl3溶液均成紫色 B.均能发生银镜反应
 C.均能与溴水反应
D.均能与NaOH溶液反应
C.均能与溴水反应
D.均能与NaOH溶液反应
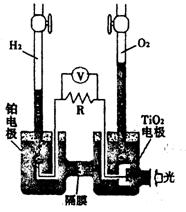
13.TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过
2H2↑+O2↑,该过
程类似植物的光合作用。右图是光照射下TiO2分解水的装
置示意图。下列叙述正确的是
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
14.利用右图进行实验,下列实验结果能说明结论的是
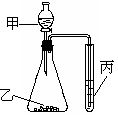 A.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
A.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
证明酸性:盐酸>H2CO3>C6H5OH
B.甲:盐酸,乙:硫化亚铁,丙:溴水。
证明还原性:S2->Br->Cl-
C.甲:水,乙:电石,丙:溴水。
证明稳定性:H2O>C2H2>Br2
D.甲:浓盐酸,乙:高锰酸钾,丙:溴化钾溶液。
证明氧化性:KMnO4>Cl2>Br2
15.下列各种溶液中,一定不能大量共存的离子组是
A.和Al反应产生氢气的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离的c(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-
C.含有大量Fe3+的溶液中:Mg2+、Al3+、Cu2+、SO42-
D.使酚酞试液变为粉红色的溶液中:K+、Na+、AlO2-、HCO3-
16.某温度下,在容积不变的密闭容器中发生下列可逆反应:X(g)+2Y(g)![]() 2Z(g),平衡时,X、Y、Z的物质的量分别为1mol、1mol、2mol,保持温度不变,再向容器中分别充入1mol、1mol、2mol的X、Y、Z,则下列叙述中正确的是:
2Z(g),平衡时,X、Y、Z的物质的量分别为1mol、1mol、2mol,保持温度不变,再向容器中分别充入1mol、1mol、2mol的X、Y、Z,则下列叙述中正确的是:
A.刚充入时,反应速率V正减小,V逆增大
B.达到新平衡时,容器内气体的百分组成和原来相同
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的密度是原来的两倍
第II卷(共86分)
三、(本题包括2小题,共14分)
17.(7分)(1)下列有关实验说法错误的是___________
A.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.用10mL量筒量取5.80mL盐酸
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
E.取用金属Na或K时,用剩的药品要放回原瓶
F.苯酚沾在皮肤上应立即用浓NaOH冲洗
G.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(2)(6分)某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度(NaOH溶液的浓度在2.0mol/L左右)。试回答下列问题:
①称取一定质量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色。
②往其中加入最适宜的指示剂 1~2滴。
③用待测NaOH溶液进行滴定,滴定终点时,现象是 。
④完成该实验主要要用到哪些玻璃仪器 (举二种)。
18.(7分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
 回答下列问题:
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_____(填实验序号)
⑵研细CuSO4·5H2O所用的主要仪器是____________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用右图装置进行实验,实验时均以生成25 mL气体为准, 其他可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g |
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B 中乳胶管,拔去干燥管上单孔橡皮塞,________________;(补全实验操作)
⑸为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.____________________________; b.CuO的化学性质有没有改变。
 四、(本题包括3小题,共38分)
四、(本题包括3小题,共38分)
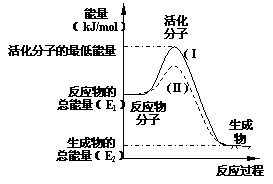
19.(8分)在化学反应中,只有极少数能量
比平均能量高得多的反应物分子发生碰撞
时才可能发生化学反应,这些分子称为活
化分子。使普通分子变成活化分子所需提
供的最低限度的能量叫活化能,其单位通
常用kJ/mol表示。请认真观察右图,然后
回答问题。
⑴ 图中所示反应是_________(填“吸热”或“放热”)
反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
⑵ 已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
⑶ 对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_ 。
20.(14分)Ⅰ.已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
(1)计算该天然气中甲烷的体积分数___________________;
(2)由上表可总结出的近似规律是____________________ _。
Ⅱ.⑴某燃料电池以熔融K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷(C4H10)为原料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属为电极。
①写出该燃料电池电极反应式:正极 ;
负极 2C4H10+26CO32--52e-====34CO2+10H2O;总反应
②为了使该燃料电池长时间稳定运行,电池电解质组成应保持稳定。为此必须在通入的空气中加入 ,它来源于
⑵已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应化学方程式为KI+3H2O![]() KIO3十3H2↑则两极反应式分别为:阴极__________ __________________
KIO3十3H2↑则两极反应式分别为:阴极__________ __________________
阳极_________________________ _
21.(16分)Ⅰ.许多小溪流经硫矿和金属矿,由于含硫矿暴露在空气中或暴露在含氧的水中,这些小溪变成酸性,溪水中含有溶解的铁和硫酸盐,它们的浓度都很高。最常见的含硫矿是黄铁矿(FeS2),其中铁的化合价为+2价;当富铁的溪水和其他水混合时,溶于水的铁以针铁矿[FeO(OH)]的形式沉淀出来,覆盖在小溪的底部,而水仍保持酸性。试回答:
(1)黄铁矿在小溪中被氧化成Fe2+和 SO42-的离子方程式为: ;
(2)Fe2+被氧化生成针铁矿的离子方程式为: ;
(3)如果黄铁矿全部转化为FeO(OH)和H+,那么要使1L纯水中H+的物质的量浓度为1×10-3mol/L,需FeS2的物质的量为 mol。
Ⅱ.次磷酸(H3PO2)是一种强还原性弱酸,它能发生下列反应:
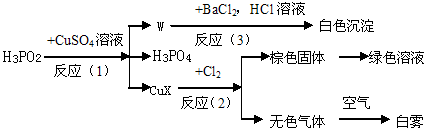
(1)CuX中X表示一种元素,这种元素是 ,其判断依据是
(2)CuX是离子化合物,其电子式为 ,
(3)反应(3)的离子方程式为 ,
(4)反应(2)中,当有1molCuX被氧化时,转移的电子数目为 个。
五.(本题包括2小题,共18分)
22. (8分)某氨基酸是天然蛋白质水解的产物,其相对分子质量不超过200,经分析可知,该氨基酸仅含C、H、O、N四种元素,其中氮元素的质量分数为8.5%,氧元素的质量分数为19.4%。
(1)该氨基酸分子中有_________个—NH2,___________个—COOH。
(2)该氨基酸摩尔质量(取整数值)为________________。
(3)若该氨基酸分子结构中含有苯环且无—CH3,写出其结构简式_____________。
23.(10分)2005年诺贝尔化学奖由法国科学家YvesChauvin、美国科学家RobertH.Orubbs、 RichardR.Schrock共同获得。以表彰他们在烯烃复分解反应方面研究与应用所作出的贡献。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。可表示为:
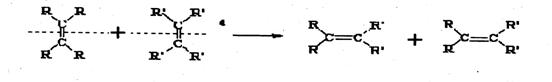
|
![]() 又已知:R-CH2-CH=CH2+Cl2
R-CHCl-CH=CH2+HCl
又已知:R-CH2-CH=CH2+Cl2
R-CHCl-CH=CH2+HCl
有机物R是烃的含氧衍生物(分子式为:C9H14O6),常用作纤维的增塑剂以及化妆晶等,F也可由油脂水解得到,有机物R的合成路线如下: 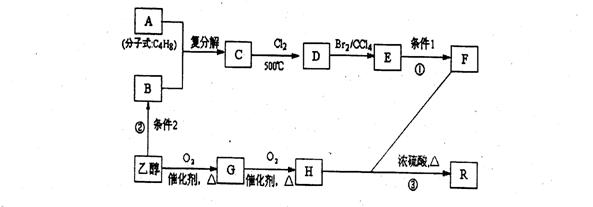 试回答下列问题:
试回答下列问题:
(1)写出反应①、②的反应条件:条件1 ;条件2 。
(2)写出结构简式,A: ;E: 。
(3)写出反应③的化学方程式: 。
六、计算题(本题包括2小题,共16分)
24.(6分)有机物A是烃或烃的含氧衍生物,分子中碳原子数不超过6。当0.1 mol A在0.5 mol O2中充分燃烧后,A无剩余。将生成的气体(1.01×105 Pa,110 ℃下)依次通过足量的无水氯化钙和足量的碱石灰,固体增重质量之比为9∶11,剩余气体的体积折算成标准状况为6.72 L。试通过计算、讨论确定A可能的化学式。
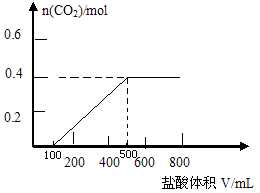
25. (10分)将35.8gNa2CO3和NaHCO3的混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。
(1)原混合物中Na2CO3为 _______________g
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图
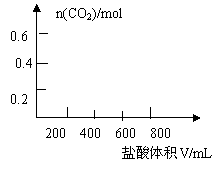 |
| V的取值范围 | n=f(V) |
|
| |
|
| |
高三第三次模拟考试(化学)答题卷
| |
⑵②
③
④
18.(7分)⑴ ⑵
⑶
⑷
| |
19.(8分)⑴
⑵
⑶
20.(14分)Ⅰ(1)
(2)
Ⅱ(1)①
②
(2)
21.(16分)Ⅰ.(1)
(2)
(3)
Ⅱ.⑴
| |
22.(8分)⑴ ⑵
| |
23.(10分)⑴ 条件1 条件2
⑵ A E
⑶
| |
25.(10分)⑴
| V的取值范围 | n=f(V) |
|
| |
|
| |
|
|
⑵
 |
化学试卷参考答卷
1.B 2.B 3.A 4.A 5.D 6.C 7.A 8.D 9.C 10.B 11.C 12CD
13.AB 14.AD 15.AD 16.D
17.⑴ B、D、F
⑵② 酚酞
③ 滴到最后一滴NaOH时,锥形瓶中溶液的颜色由无色变成粉红色,且半分钟内不褪色
④ 碱式滴定管 锥形瓶 (或其他玻璃仪器)
18.⑴ ①②③
⑵ 研钵 ⑶ 时间
⑷ 取一根带火星的木条,伸入干燥管内,看木条是否复燃
⑸ CuO的质量有没有改变
19.⑴ 放热 需要 -(E1-E2 )kJ/mol
⑵ 409 kJ/mol
⑶ 使用了催化剂
20.Ⅰ.(1)72%
(2)烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右
Ⅱ.⑴① O2+4e-+2CO2==2CO32- 2C4H10+13O2==8CO2+10H2O
②CO2;电池负极产物
⑵6H2O+6e-=3H2↑+6OH- I-+3H2O-6e-=IO3-+6H+
21.Ⅰ. (1)2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+
(2)4Fe2++O2+6H2O=4FeO(OH)↓+8H+
(3)2.5×10-4
Ⅱ.(1)H,CuX与Cl2反应生成HCl,则CuX中必含有氢元素
(2)Cu+[:H]- (3)Ba2++SO42-=BaSO4↓ (4)1.806×1024
22.⑴ 1 1 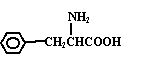 ⑵ 165g/mol
⑵ 165g/mol
⑶
23.⑴ 条件1 氢氧化钠水溶液,加热 条件2 浓硫酸,170℃(加热)
⑵ A CH3CH=CHCH3 E CH2C1CHBrH2Br
(3) 3CH3COOH+C3H5(OH)3-----C3H5(OOCCH3)3+3H2O
24.(1)若剩余氧气,则由二氧化碳与水的物质的量之比,可知有机物中C、H原子个数比为1∶4。
可假设有机物化学式为(CH4)mOn,列式讨论,得该有机物为CH4。
(2)若剩余气体为CO,则由有机物、氧气、一氧化碳的物质的量分别为0.1mol、0.5mol、0.3mol,可知反应中化学计量数之比。假设该有机物化学式为CXHYOZ。
![]() CXHYOZ+5O2
3CO+(x-3)CO2+
CXHYOZ+5O2
3CO+(x-3)CO2+![]() H2O
H2O
由CO2与H2O物质的量之比为1﹕2得: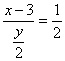 ①
①
由氧原子守恒得:Z+10=3+(2X-6)+![]() ②
②
综合①②得:Z=4X-19
讨论知:X=5时,Z=1,有机物化学式为:C5H8O。
X=6时,Z=5,有机物化学式为:C6H12O5。
25.(1)10.6
(2) 0ml ≤V ≤100ml n=0
100ml <V ≤500ml n=(V×10-3-0.1)mol
V >500ml n=0.4mol