高三化学第二复习专题强化训练1
化学反应及能量变化
班级 姓名 座号 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
可能用到的相对原子质量:Fe:56 Al:27 C:12 H:1 O:16
一、选择题(每小题有1到2个正确答案,共60分)
1.有关反应:4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是
A.Al是还原剂,TiC是氧化产物
B.TiO2是氧化剂,TiC是还原产物
C.反应中氧化剂与还原剂的物质的量之比是3:4
D.生成1molTiC转移4mol电子
2.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.NaClO(aq)中通入过量CO2:ClO-+CO2+H2O=HClO+HCO![]()
B.FeCl2在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.AlCl3(aq)中投入过量Na:2Al3++6Na+6H2O=2Al(OH)3↓+6Na++3H2↑
D.FeBr2(aq)中通入少量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
3.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = -24.8kJ/mol
Fe2O3(s)+2/3 CO(g) = 2/3Fe3O4(s)+1/3 CO2(g) △H = -15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H = +640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
![]() 4.
在室温下,某溶液中由H2O H++OH—这一途径产生出来的H+和OH—浓度的乘积为1×10—26,则此溶液中可能大量共存的离子组为
4.
在室温下,某溶液中由H2O H++OH—这一途径产生出来的H+和OH—浓度的乘积为1×10—26,则此溶液中可能大量共存的离子组为
A.HCO3—、Al3+、H+、SO42— B.SiO32—、ClO—、Na+、K+
C.Cu2+、Cl—、NO3—、K+ D.I—、Fe3+、SCN—、NH![]()
5. 下列反应的离子方程式中,正确的是
A.电解饱和食盐水:2C1-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用食醋溶解热水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑
C.二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
D.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
6.在下述条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Ba2+、I-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.c(HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+
7.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3 Na2FeO4+ NH3↑+7NaOH
③Na2FeO2+ Na2FeO4+2H2O=Fe3O4+4NaOH
下列说法正确的是
A.反应①是氧化还原反应
B.该生产过程不产生任何污染
C.整个反应过程中,每有5.6gFe参加反应转移0.8mol电子
D.反应②中的氧化剂是NaNO2
8.下列离子方程式书写错误的是
A、小苏打中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D、明矾溶液加入Ba(OH)2溶液至Ba2+恰好完全沉淀: Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
9.某浓度的硝酸与过量铁粉反应时生成了4.48LN2O气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是
A.13.5g B.9g C.27g D.8.9g
10.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol 。下列热化学方程式中,正确的是.
A.C(s)+1/2O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l);△H=-571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
二、填空题(40分)
11.(10分)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式: ;
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是:
。
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的
| |
12.(10分)2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中第二条是:储氢纳米碳管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质——纳米颗粒。这种碳纳米颗粒可借氧化气法提纯。其反应式是:
![]()
![]() C+ K2Cr2O7+ H2SO4=
+ K2SO4+ Cr2(SO4)3+
C+ K2Cr2O7+ H2SO4=
+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式,标出电子转移的数目和方向。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A、酸性 B氧化性 C吸水性 D脱水性
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是 mol。
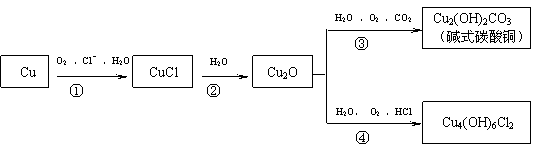 13.(10分)铜是人类最早熟悉的金属之一,埋藏在地下的青铜器锈蚀过程中形成一系列难溶性的铜的化合物,锈蚀过程可以表示为:
13.(10分)铜是人类最早熟悉的金属之一,埋藏在地下的青铜器锈蚀过程中形成一系列难溶性的铜的化合物,锈蚀过程可以表示为:
(1)Cu2O的颜色为 ,Cu4(OH)6Cl2的名称为
(2)青铜器出土后,防止青铜器继续锈蚀的关键是
(3)反应①的离子方程式是
(4)反应③的化学方程式是
14(10分)能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧的热化学方程式:
。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.100g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.200mol·L-1的K2Cr2O7溶液,再用0.3000mol·L-1(NH4)2
Fe(SO4)2标准溶液滴定,耗去此标准液20.200mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+ CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
。
②盛装(NH4)2Fe(SO4)2标准溶液的应为 (“酸式”或“碱式”)滴定管。如果达滴定终点时,仰视读数,则读数偏 。(“大”或“小”)
③此工业甲醇中CH3OH的质量分数 。
高三化学第二复习专题强化训练1参考答案
1-10 CD、A、B、BC、AC、C、AD、AB、A、BD
11.(1)4H++4I-+O2=2I2+2H2O(2分)
|
|
(3)2P + 3I2 2PI3 (2分);PI3 + 3H2O 3HI + 3H3PO3(2分)
|
|
|
(4分。其中填化学式1分、配平2分,电子转移方向和数目1分)
(2) K2Cr2O7、CO2 (2分) (3) A (2分) (4) 0.4mol (2分)
13.(每空2分)(1)砖红色,碱式氯化铜(2)隔绝空气和水
(3)2 H2O+4Cu+O2+4Cl-=4CuCl+4OH-
(4)2Cu2O+2H2O+O2+2CO2=2 Cu2(OH)2 CO3
14.(10分,每空2分)
(1)2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(1)△H=-1451.52kJ/mol
(2)①6Fe2++Cr2O72-+14H+ 6Fe3++7H2O+2Cr3+
②酸式 大 ③96%
高三化学第二复习专题强化训练1参考答案
1-10 CD、A、B、BC、AC、C、AD、AB、A、BD
11.(1)4H++4I-+O2=2I2+2H2O(2分)
|
|
(3)2P + 3I2 2PI3 (2分);PI3 + 3H2O 3HI + 3H3PO3(2分)
|
|
|
(4分。其中填化学式1分、配平2分,电子转移方向和数目1分)
(2) K2Cr2O7、CO2 (2分) (3) A (2分) (4) 0.4mol (2分)
13.(每空2分)(1)砖红色,碱式氯化铜(2)隔绝空气和水
(3)2 H2O+4Cu+O2+4Cl-=4CuCl+4OH-
(4)2Cu2O+2H2O+O2+2CO2=2 Cu2(OH)2 CO3
14.(10分,每空2分)
(1)2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(1)△H=-1451.52kJ/mol
(2)①6Fe2++Cr2O72-+14H+ 6Fe3++7H2O+2Cr3+
②酸式 大 ③96%