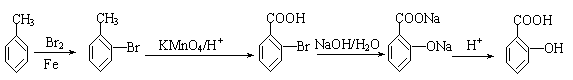高三化学第二轮复习专题强化训练10
化学选考部分
班级 姓名 座号 成绩
可能用到的相对原子质量:Fe:56 Al:27 C:12 H:1 O:16 Mg:24 P:31 K:39 Cu:64 Na:23
以下每题均为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
![]() 1.(A)(10分) 生产工程塑料PBT(
)的重要原料
1.(A)(10分) 生产工程塑料PBT(
)的重要原料
G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平
面。
请你结合下列所给有关信息,回答问题。
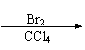
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
![]()
![]() Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅲ.
![]() Ⅳ.
Ⅳ.
⑴写出E和F的结构简式: 、 。
⑵写出反应⑤的化学反应方程式: 。
⑶请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
![]() 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
![]() B C
…… G
B C
…… G
(B)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|
| |||||||||||||||
| b |
|
|
| c | d | e | f |
| |||||||||
| g | h | i | j |
| k | l | m | ||||||||||
| n |
|
|
|
|
|
| o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物的分子构型为 ,中心原子的杂化形式为 ;k在
空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分
 子是 (填“极性”或“非极性”)分子。
子是 (填“极性”或“非极性”)分子。
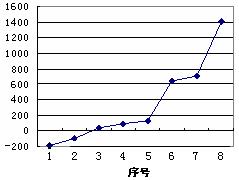
(3)第三周期8种元素按单质熔点高低的顺序如
右图,其中序号“8”代表 (填元素符号);
其中电负性最大的是 (填右图中的序号)。
(4)由j原子跟c原子以1 : 1相互交替结合而形
成的晶体,晶型与晶体j相同。两者相比熔点
更高的是 ,试从结构角度加以解释:
2.(A)(10分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛外观似钢,具有银灰光译。钛的特性是强度大,密度小(4.51g/cm3),硬度大,熔点高(1675℃),自1791年英国牧师格列高尔发现钛至今,钛和钛的合金已被广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等,被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第 周期,第 族;其基态原子的价电子层排布为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。
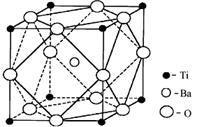
① 偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是 。
② 已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品样配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,绿色晶体中含有的化学键类型是 ,该配合物中的配位体是 。
(B)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
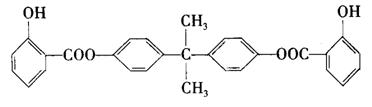
已知G不能发生银镜反应。BAD的合成路线如下:
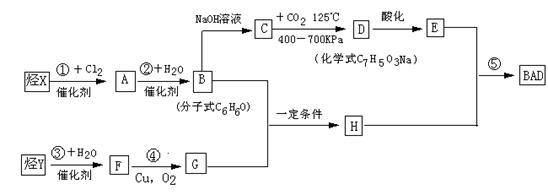
试回答下列问题
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ;
B+G→ H 。
3.(10分)(A)已知一个碳原子上连有两个羟基时,易发生下列转化:
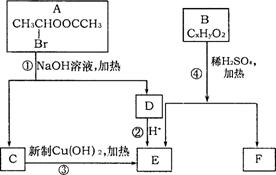
![]()
请根据右图回答:
(1)E中含有的官能团的名称是
;反应③的化学方程式为
(2)已知B的相对分子质量为162,
其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为 。
(3)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结
构,写出其中两种环上取代基个数不同的同分异构体的结构简式
(B)Al单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
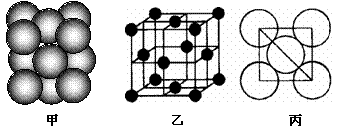 |
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
(1)Al元素的基态原子电子排布式是
(2)晶胞中i原子的配位数为___ ___ ,一个晶胞中Al原子的数目为_ _。
(3)该晶体的密度为______ _(用字母表示)。
4.(A)(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是 (填化学式),其原因是 ;
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有 ;
(3)E原子的电子排布式为: ;
(4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后, 极(填电极名称)附近出现红色;另一极的电极反应式为 ,可用 检验该极所得产物。电解的总反应方程式为
(B)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目。
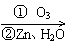 |
如:(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
且已知:CH2=CH-OH(烯醇式结构:碳碳双键连接羟基)不能稳定存在
已知某有机物A经臭氧氧化分解后发生下列一系列的变化:
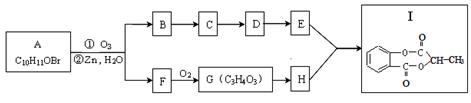
试回答下列问题:
(1)F可能的结构有两种,请写出结构简式 、 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)G制取H的化学方程式:
指明反应类型:
5.(10分)(A)(1)某蓝色晶体化学式可表示为:MxFey(CN)z 。用X射线研究其结构特征
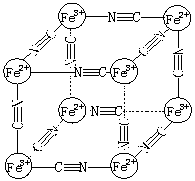 如右图所示:
如右图所示:
Fe2+和Fe3+分别占据立方体的顶点且互不相邻,而CN— 位于立方体
的棱上。则下列说法正确的是
A.该晶体是共价化合物
B.该晶体的化学式可表示为MxFe2(CN)6
C.该晶体中既有离子键、又有极性共价键
D.M的离子位于上述晶胞体心,呈+2价
(1)PH3在常温下是一种无色、剧毒、易自燃的气体,
分子结构与NH3相似。在常温下1体积的水能溶解
0.26体积的PH3, PH3和卤化氢HX作用生成相应的化合物PH4X, PH4X在水溶液中完全水解(PH4+结构类似于CH4).
①写出P的核外电子的排布式
②PH3分子结构的形状是 , 和H+的结合能力较NH3 (填强或弱)
PH4+里,P-H键之间的夹角
③ 化学方程式表示PH3在空气中自燃的反应
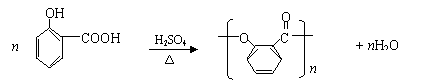
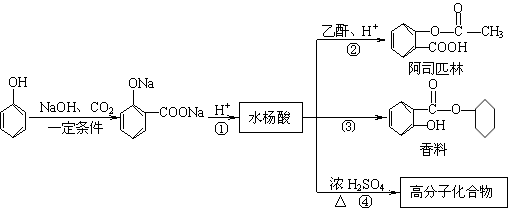 (B)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
(B)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
回答下列问题:
⑴ 在反应①~④中属取代反应的是________________。
⑵ 写出反应④的化学方程式________________________________________________。
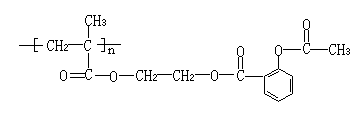 ⑶ 把阿司匹林分子连接在某高分子化合物上,便可形成结构如下的缓释长效药剂:
⑶ 把阿司匹林分子连接在某高分子化合物上,便可形成结构如下的缓释长效药剂:
长效阿斯匹林完全水解后生成的有机物有 种。
⑷ 甲苯也可用来合成水杨酸。请设计合理方案由甲苯合成水杨酸(用反应流程图表示,并注明反应条件)。

高三化学第二轮复习专题强化训练10参考答案
1.(A)⑴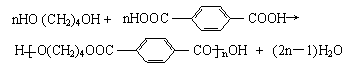 CH2=CHCl HOCH2C≡CCH2OH (4分)
CH2=CHCl HOCH2C≡CCH2OH (4分)
⑵
(2分)
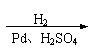 | |||
 | |||
⑶ CH≡CCH=CH2 CH2=CHCH=CH2
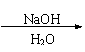
![]()
CH2BrCH=CHCH2Br Br(CH2)4Br HO(CH2)4OH (4分)
(B)每空1分(1)1s22s22p63s23p63d64s2 (2) 三角锥形 sp3 角形(或V形) sp2 极性 (3) Si 2 (4)SiC(或jc,或前者)
⑩ 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。
2.(A)(10分)
(1)四周期;ⅣB族;3d24s2 (各1分,共3分)。
(2)①BaTiO3 (1分); ②绿色晶体的化学式是[TiCl(H2O)5]Cl2·H2O(1分);离子键、极性共价键、配位键(3分);H2O、Cl-(2分)。
(B)(10分)
(1)CH3CH=CH2 (1分) ; 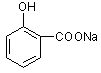 (1分)。
(1分)。
(2)①②⑤(3分,每答对一个得1分,只要答错一个就为0分)。
(3)6(1分)。
(4)2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O
(2分)。
2CH3COCH3+2H2O
(2分)。
CH3COCH3+2C6H5OH![]()
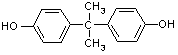 +H2O(2分)。
+H2O(2分)。
3.(A)(1)羧基(2分)
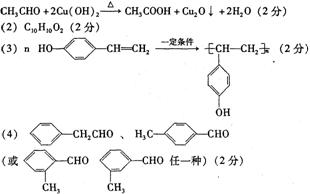
(B)(1)1s22s22p63s23p1(2)12,4[以上每空2分](3)(4分)
4.(A)(1)H2O(1分),分子间形成了氢键(1分)。
(2)σ键π键(1分)
(3)1s22s22p63s23p63d104s24p5(2分)
(4)阴(1分);2Cl——2e—→ Cl2↑(1分) , 湿润的淀粉碘化钾试纸(1分)。
2NaCl + 2H2O
![]()
![]() 2NaOH + H2↑+Cl2↑(2分,未写反应条件和未配平扣1分)
2NaOH + H2↑+Cl2↑(2分,未写反应条件和未配平扣1分)
(B)(1) CH3COCH2OH、CH3CH(OH)CHO(各2分,共4分)
(2)B(2分)
(3) CH3COCOOH+H2![]() CH3CHOHCOOH(2分)
CH3CHOHCOOH(2分)
加成反应或还原反应(1分)
5.(A)(1)丙醇(4分)(2)[每个答案1分]①1S22S22P63S23P3②三角锥形,弱,109°28 ③2 PH3+4O2=P2O5+3H2O,P2O5 +3H2O=2H3PO4
(B)(1) ②③④ (2分)
 |
(2) (2分)
(3) 4种 (2分 )
(4) (4分)