高三化学第二复习专题强化训练2
物质的量
班级 姓名 座号 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
可能用到的相对原子质量:Fe:56 Al:27 C:12 H:1 O:16 Mg:24 P:31 K:39 Cu:64 Na:23
一、选择题(每小题有1到2个正确答案,共100分)
1.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是
A.1mol/L氨水中,NH3·H2O的分子数小于6.02×1023
B.2.4g金属镁变为镁离子时失去的电子数为0.2×6.02×1023
C.白磷分子(P4)呈正四面体结构,31g 白磷中含有P—P键个数为6×6.02×1023
D.20g 重水(2H216O)中含有的中子数为10×6.02×1023
2.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.乙烯、丙烯的混合物1.4g中含有0.1NA个碳原子
B.用电解法精炼铜时转移0.1NA个电子时阳极溶解6.4g铜
C.13.6g熔融的KHSO4中含有0.2NA个阳离子
| |
3.将物质的量均为a mol的钠和铝一同投入mg足量水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
4.20℃时,将a g硝酸钾溶于b g水中,恰好形成V mL饱和溶液。下列关系式错误的是
A. 该溶液物质的量浓度c(KNO3)=
![]() mol/L
mol/L
B. 该溶液的质量分数ω(KNO3)=
![]() %
%
C. 20℃时硝酸钾的溶解度S= ![]() g
g
D. 该溶液的密度ρ=(a+b)/V g/L
5.物质的量浓度相同的NaNO3、Mg(NO3)2、Al(NO3)3三种溶液,取三种溶液的体积比为
3:2:1时,三种溶液中c(NO3-)之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.3:4:3
6.25℃时,硫酸铜的溶解度为sg,把sg无水CuSO4粉末加入到(100+s)g饱和CuSO4溶液中,得到一定量的蓝色晶体,若将此晶体溶解制成饱和溶液,应加入水的质量是
A. 100g B.(100+s)g
C.(100+9/25)g D.(100-16/25)g
7.用NA代表阿伏加德罗常数,下列说法正确的是
A.46 g NO2和N2O4的混合物含有的分子数为1 NA
B.18 g水中含有的电子数为10 NA
C.0.5 mol Al与足量盐酸反应转移电子数为1 NA
D.标准状况下,22.4 L辛烷完全燃烧生成二氧化碳分子数为8 NA
8.用NA表示阿伏加德罗常数,下列说法正确的是
A、1molCl2与足量的铁反应转移的电子数是3NA
B、在20℃,1.01×105Pa时,2.8g C2H4和CO的混合气体中所含气体分子数为0.1NA
C、7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA
D、1mol氧单质含有的原子数是1mol氖气含有的原子数的两倍
9.用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.反应Cu2S+O2![]() 2Cu+SO2(Cu2S中的Cu元素为+1价)生成1molCu,电子转移数为3NA
2Cu+SO2(Cu2S中的Cu元素为+1价)生成1molCu,电子转移数为3NA
B.常温时,2L 1 mol·L-1的醋酸溶液中,所含分子总数大于2NA
C.1mol FeCl3溶于水中,溶液中离子数为4NA
D.1 molNH2-中含电子数为NA
10.NA代表阿伏加德罗常数的值,下列说法正确的是
A、在2L升2mol/L的(NH4)2SO4溶液中所含的NH4 +的数目是8NA
B、常温常压下,2molCaC2晶体中含有的阴离子数为 2NA
C、在Cu与S的反应中,1molCu失去的电子数为NA
D、标准状况下,22.4L三氧化硫中含有NA个三氧化硫分子
11.用NA表示阿伏加德罗常数,下列叙述中正确的是
A.12 g金刚石晶体中含有碳碳键的数目为4NA
B.46 g四氧化二氮和二氧化氮的混合物中含有的原子总数一定为3NA
C.56 g铁粉与硝酸反应失去的电子数一定为3NA
D.将1 mol FeCl3制成胶体分散系,其中分散质粒子数为NA
12.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是不饱和溶液 B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度为75 g D.原溶液中A的质量分数为40%
13.NA表示阿佛加德罗常数,下列说法不正确的是
A.标准状况下,1.12LDT所含的中子数为0.15NA
B.8.0gCuO被CO完全还原,转移电子数为0.2NA
C.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为22.4d /NAg
D.1L0.1mol/L的硫化钠溶液中硫离子数目为0.1NA
14.已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
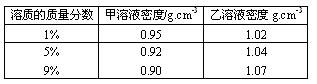
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
C.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
15.阿伏加德罗常数约为6.02×1023mol-1 ,下列说法中,正确的是
A.22.4 L HCl中含有的分子数约为6.02×1023
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数约为3×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
16.设NA为阿伏加德罗常数,下列说法正确的是
A.在标准状况下,22.4L H2O中O原子数为NA
B.常温常压下,35.5g Cl2中Cl原子数为NA
C.在pH=13的NaOH溶液中,OH-的数目为0.1NA
D.1molCH4中,所含共价键的总数为5NA
17.设NA代表阿伏加德罗常数,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属
B.常温下含有NA个NO2、N2O4分子的混合气,温度降至标准状况,其体积约为22.4L
C.1g钾所含的电子数![]()
D.0.1mol 24Mg32S晶体中所含中子总数为2.8NA
18.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.标准状况下,1molNa2CO3投入足量稀盐酸中,反应完后,可逸出个6.02×1023个CO2分子
B.7.1g氯气与足量石灰乳充分反应转移电子数为6.02×1022
C.常温常压下体积均为11.2L的CO2和SiO2所含有的氧原子数都是6.02×1023
D.新戊烷与异戊烷的混合物7.2g中所含共价键数目为1.6×6.02×1023
19.氢氧化镁难溶于水,但溶于水的部分完全电离。室温下将一药匙氢氧化镁加入盛有200mL蒸馏水的烧杯中,充分搅拌后过滤,测得滤液的 pH=11,密度为1.0g·cm-3,则该温度下氢氧化镁的溶解度为
A. 2.9×10-2 g B. 2.9×10-3 g C. 5.8×10-2 g D. 5.8×10-3 g
20.设NA为阿伏加德罗常数。下列叙述正确的是
A.物质的量相等的Na2O和Na2O2晶体,所含有离子个数相同
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,氢离子(H+)数目等于NA
C.1molCH3+(碳正离子)中含电子数目为8NA
D.1mol丙烯酸含有的双键数目为NA
高三化学第二复习专题强化训练2参考答案
1-10 BD、A、C、AD、B、A、B、BC、AB、BC 11-20 B、AB、D、C、BC、B、CD、BD、B、AC