高三化学第二复习专题强化训练3
原子结构与元素周期律
班级 姓名 座号 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
可能用到的相对原子质量:Fe:56 Al:27 C:12 H:1 O:16 Mg:24 P:31 K:39 Cu:64 Na:23
一、选择题(每小题有1到2个正确答案,共60分)
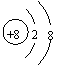 1.下列各项表达式正确的是
1.下列各项表达式正确的是
A.O2―的结构示意图:
B.Na2S的电子式:![]()
C.甲醛的结构简式:CH2O
D.氮分子的结构式:![]()
2.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子从内到外各电子层的电子数之比为1:4:1。则下列叙述正确的是
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A,C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
3.下列有关物质的结构或性质的叙述错误的是
A.H3BO3、H2CO3、HNO3的酸性逐渐增加
B.BeSO4、MgSO4、CaSO4、BaSO4的溶解性逐渐减弱
C.S2-、Cl-、K+、Ca2+的离子半径依次增大
D.NH3、PH3的水溶性依次降低
4.下列说法中正确的是
A.最外层有2个电子的原子(除氦外)都是金属原子
B.原子最外层电子数相同的不同元素,其单质的化学性质一定相似
C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D.溴元素位于周期表的第7纵行
5.下列叙述正确的是
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
C.甲烷、白磷的分子都是正四面体结构,因此它们分子中化学键之间的夹角相同
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11
6.X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。下列说法正确的是
A.X、W、Z、Y的原子序数依次增大
B.Y不能把溴从溴化物中置换出来
C.Z的氧化物通常形成分子晶体
D.存放W单质的仓库失火不能用CO2灭火
|
|
| |||
|
| X |
|
|
|
| W |
| Y | R |
|
|
|
|
| Z |
|
7.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z
五种元素的叙述中,正确的是
A W、Y、Z元素的氢化物稳定性逐渐减弱
B. Z元素的最高氧化物对应的水化物的酸性最强
C. Y元素的氢化物沸点比与其同族且原子序数小的元素的氢化物的沸点高
 D
X元素的非金属性比W元素的非金属性强
D
X元素的非金属性比W元素的非金属性强
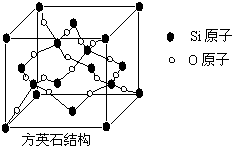
8.二氧化硅有晶体和无定形两种形态,晶态二氧化硅主
要存在于石英矿中。除石英外,SiO2还有鳞石英和方英
石等多种变体。方英石结构和金刚石相似,其结构单元
如下图:
下列有关说法正确的是
A.方英石晶体中存在着SiO4结构单元
B.1molSi原子形成2molSi-O键
C.上图所示的结构单元中实际占有18个Si原子
D.方英石晶体中,Si-O键之间的夹角为109°28′
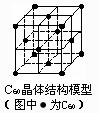 9.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
9.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
A.熔点比较:C60<C70<C90<金刚石
B.已知C(石墨,s)![]() C(金刚石,s);△H>0,则石墨比金刚石稳定
C(金刚石,s);△H>0,则石墨比金刚石稳定
C.C60晶体如图,每个C60分子周围与它距离最近且等距离的C60分子有10个
D.金刚石与C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
10.在周期表的前三个周期中,位置相邻的三种元素的质子数之和为33,则有关这三种元素的下列说法正确的是
A.可能在同一周期 B.可能在同一主族
C.可能有两种元素在第二周期 D.可能有两种元素在第三周期
二、填空题(40分)
11.(10分)A、B、C三种元素都是短周期元素,它们的原子核外电子层数相同。A、B元素各自形成的A离子和B离子均和Ne元素的原子电子层结构相同,A元素的氢氧化物比B元素的氢氧化物碱性强。5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应。C元素的单质化学性质活泼但不能直接和氧气反应。根据上述条件,回答下列问题:
(1)A元素和C元素形成化合物的晶体类型是____ ____晶体。
(2)C元素在元素周期表中的位置是 ;C的最高价氧化物的分子式为 。
(3)B的氢氧化物与盐酸反应的离子方程式: 。
(4)C元素的单质,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
12.(12分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
13.(8分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(数据单位相同)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部数据。
| (H) 13.6 |
|
|
|
|
|
| (He) 24.6 54.4 |
| (Li) 5.4 75.6 122.5 | (Be) 9.3 18.2 153.9 217.7 | (B) 8.3 25.2 37.9 259.4 340.2 | (C) 11.3 24.4 47.9 64.5 392.1 489.9 | (N) 14.5 29.6 47.4 72.5 97.9 552.1 …… | (O) 13.6 35.1 …… …… …… …… …… | (F) 17.4 34.9 …… …… …… …… …… | (Ne) 21.6 41.6 …… …… …… …… …… |
⑴每组数据可能是该元素的 。
A.原子得到电子所放出的能量 B.单质在不同条件下的熔、沸点
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径大小
⑵稀有气体元素的第一个数据较大的原因是_______________________________
_ __;请你推测镁和铝的第一个数据的大小Mg_____Al。
⑶同一元素原子的一组数据中,有的数据增大特别多,形成突跃,这些数据出现的规律,说明原子结构中 。
14.(10分)元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
⑴ 短周期元素中,原子最外层电子数和电子层数相等的元素有 种。

⑵ 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为
;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为
。
⑶ 原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式 。
⑷ 第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为 g。
高三化学第二复习专题强化训练3参考答案
1-10 A、A、C、AC、D、AD、D、AD、CD、CD
11.(每空2分)(1)离子(2)第三周期VIIA族 ; Cl2O7
(3)Mg(OH)2+2H+==Mg2++2H2O
(4)Cl2+2OH-=2Cl-+ClO-+H2O
12.(1)10-4:1(4分)
(2)Ba2++HCO3-+ OH-==BaCO3↓+H2O(4分)
(3) Al+4OH-==AlO2-+2H2O +3e—(4分)
13.⑴C
⑵稀有气体元素原子的最外层电子排布已达到8电子(He为2电子)的相对稳定结构,较难失去电子 >
⑶原子核外电子是分层排布的 (每空2分,共8分)14.(1)3 (2分) (2) HF Si (4分)
![]() (3)NH4+ +2H2O NH3·H2O +OH― (2分)
(3)NH4+ +2H2O NH3·H2O +OH― (2分)
(4)15 (2分) (本题共10分)