电化学专题复习
考点分析
(1)了解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
(2)理解电解原理。了解铜的精炼、镀铜、氯碱工业反应原理。
典型例析
例1、[2004高考江苏] 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
解析:根据电池总反应式,锌发生氧化反应,失去电子作电池的负极,电子经外电路流向正极。两极的电极反应式为:
负极:Zn(s)+2OH-(ag)-2e-=Zn(OH)2(s)
正极:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(ag)
电极 放电时,1mol Zn失去2mol电子,所以当通过0.2mol电子时,消耗Zn的物质的量为0.1mol,锌的质量减小6.5g。
答案: C
例 2.(2005江苏)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
2.(2005江苏)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
【分析】本题属于基本概念与理论的考查,落点在原电池反应的机理及原电池电极反应式书写、简单的氧化还原计算。该题考查考生对电化学部分知识掌握的状况,以及在理解的基础上运用相关知识的能力。解决方法是:A是关于负极反应式的判断,判断的要点是:抓住总方程式中“放电”是原电池、“充电”是电解池的规律,再分析清楚价态的变化趋势,从而快速准确的判断,A是正确的。B是充电时的阳极方程式,首先判断应该从右向左,再判断阳极应该是失去电子,就应该是元素化合价升高的元素所在的化合物参加反应,然后注重电子、电荷以及元素三个守恒,B正确;C主要是分析原总方程式即可,应该是1mol K2FeO4被还原,而不是氧化。D选项中关于放电正附近的溶液状况,主要是分析正极参加反应的物质以及其电极反应式即可,本答案是正确的。应次该题应选C。
例3、[2004年高考四川吉林] 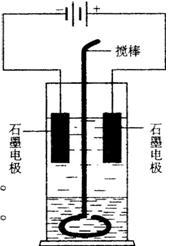 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为___________________。
(2)阴极上的电极反应式为__________________。
(3)原上层液体是__________________________。
(4)原下层液体是__________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是 _____________________________,
现象是___________________________________________________________。
解析:根据“下层液体呈紫红色”,可以推断有碘存在。再根据“两种”“无色”的“互不相溶”的“中性”“液体”这句话,可以判断下层是密度比水大的有机溶剂,上层是碘化钾或碘化钠的水溶液,但不能写成碘化铵的水溶液,因为碘化铵水解呈酸性,与题目的已知条件不符!要检验上层溶液中的金属离子是Na+还是K+,由于中学所涉及的钠盐与钾盐都易溶于水,不会形成沉淀,通常是做焰色反应实验。
答案:(1)2I--2e-=I2。 (2)2H++2e-=H2↑ (3)KI(或NaI等)水溶液。
(4)CCl4(或CHCl3等)。(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中。 (6)焰色反应:透过蓝色钴玻璃观察火焰呈紫色。
方法归纳
1、 方法与技巧
在复习电化学时,可通过对“三池”如下问题的思考,找出共性,明确差异,挖掘规律,突破难点。①这三种装置有何相似和相异的特点?②“三池”对电极有何要求?为什么?③“三池”对电解质溶液有何要求?为什么?④阴、阳离子放电顺序是怎样确定的?⑤怎样根据离子放电顺序和电极材料来分析“三池”反应的产物?⑥怎样根据离子放电顺序和电极反应判断电解质溶液PH的变化?⑦怎样用电极反应式和总反应方程式来表示“三池”的变化原理?这两种表示式如何进行书写变换?⑧“三池” 装置中,怎样判断正、负极或阴、阳极?书写电极反应式的技巧是将电池总反应式中失去电子的反应定为负极反应,得到电子的反应定为正极反应,具体的化学式形式根据总反应式和溶液的酸碱性进行判断。
 2、命题趋向:电化学的内容是历年高考的重要知识点之一,主要以选择题的形式出现,考查的内容有:原电池、电解池、电镀池的电极名称及根据总反应方程式书写原电池各电极反应式、根据电解时电极变化判电极材料或电解质种类、根据反应式进行计算、与电解池及电镀池精炼池进行综合考查、提供反应方程式设计原电池、提供电极材料电解质溶液进行原电池是否形成的判断、与图像进行结合考查各电极上质量或电解质溶液溶质质量分数的变化等。其中原电池的工作原理及其电极反应式的书写、电解产物的判断和计算是高考命题的热点。
2、命题趋向:电化学的内容是历年高考的重要知识点之一,主要以选择题的形式出现,考查的内容有:原电池、电解池、电镀池的电极名称及根据总反应方程式书写原电池各电极反应式、根据电解时电极变化判电极材料或电解质种类、根据反应式进行计算、与电解池及电镀池精炼池进行综合考查、提供反应方程式设计原电池、提供电极材料电解质溶液进行原电池是否形成的判断、与图像进行结合考查各电极上质量或电解质溶液溶质质量分数的变化等。其中原电池的工作原理及其电极反应式的书写、电解产物的判断和计算是高考命题的热点。
课堂训练
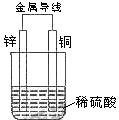
1、(2005上海)关于如图所示装置的叙述,正确的是( )
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
 C、电流从锌片经导线流向铜片
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
2、如图右图所示,在一U型管中装入含有紫色石蕊的![]() 试液,通直流电,
试液,通直流电,
一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是
A、蓝、紫、红 B、红、蓝、紫
C、红、紫、蓝 D、紫、红、蓝
3.把锌片和铁片放在盛有稀食盐水和酚酞混合液的表面皿中,如下图
所示,最先观察到酚酞变红现象的区域是…………………………………( )
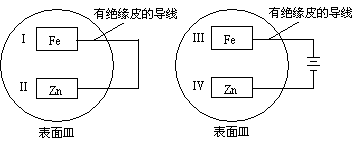
A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
4、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱标有“+”,另一个接线柱标有“-”。关于标有“+”的接线柱,下列说法正确的是 ( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
5.下列既可以是原电池发生的电极反应,又可以是电解池发生的电极反应式的是( A )
①![]() ②
②![]() ③
③![]()
④![]() ⑤
⑤![]() ⑥
⑥![]()
A ①③④ B ①②④⑥ C ②③④⑤ D ②④⑥
6.有关右图装置中的叙述正确的是
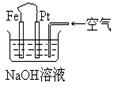 A.这是电解NaOH溶液的装置
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
7.常温下用惰性电极电解1L足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变)( )
A.pH=n B.pH=-lg n C.pH=14-lgn D.pH=lgn+14
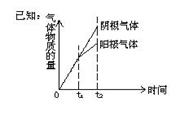
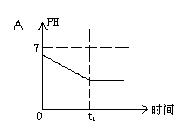
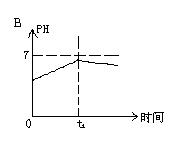
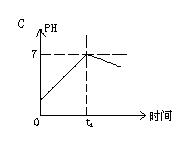
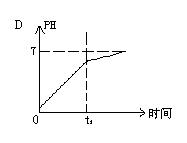
8.已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如图所示,则电解过程中溶液pH随时间变化关系正确的是( B)
9.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为KI+H2O→KIO3+H2↑。下列有关说法中,正确的是
A.电解时,石墨做阳极,铁作阴极 B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
10、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
11、下图为持续电解含有一定CaCl2水溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中,请在下图中完成左图实验中电流对时间的变化关系图,并填空回答:
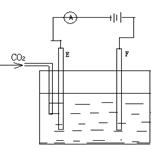
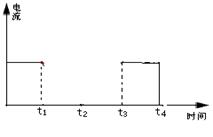
CaCl2溶液(滴有酚酞)
(1)电解时,F极发生 反应,电极反应式为
E极发生 反应,电极反应式为
总反应式为 。
(2)电解池中产生的现象:(1) ;(2) ;(3) 。
12、铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的,位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中其中+3较为稳定。我校化学兴趣小组对铬的化合物进行探究性研究。
(1)Cr2O3微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其电离方程式是: 。
(2)工业上和实验室中常见的铬(+6价)化合物是其含氧酸盐,如铬酸盐和重铬酸盐,以K2Cr2O7和Na2Cr2O7最为重要。在K2Cr2O7溶液中存在着Cr2O72—与CrO42—,并达到以下平衡:
![]() Cr2O72—+H2O 2 CrO42—+2H+
Cr2O72—+H2O 2 CrO42—+2H+
(橙红色) (黄色)
当H+浓度增大时,平衡向生成 方向移动,溶液呈 色;当OH—浓度增大时,则因消耗H+,会使平衡向生成 方向移动,溶液呈 色。
工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,使废水中的铬含量达排放标准。
①在装置中应该用 (填材料名称)做电解池的阳极,阴极上电极反应方程式是 。
②Cr2O72- 在酸性条件下有强氧化性,试写出Cr2O72-转变成Cr3+的离子方程式。
。
(3)在试管中加入3mL硫酸酸化的K2Cr2O7溶液然后向其中滴加乙醇,可观察到橙红色褪去,变为绿色。重铬酸钾可被乙醇还原,写出其化学反应方程式:
。
课后训练
1、下列叙述中错误的是
A、电解池的阳极上发生氧化反应,阴极上发生还原反应;
B、原电池跟电解池连接后,电子从电池负极流向电解池阳极;
C、电镀时,电镀池里的阳极材料发生氧化反应;
D、电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气。
2、下列叙述中,正确的是: A.钢铁腐蚀的负极反应为:Fe-3e-=Fe3+
B.Mg—Al及NaOH溶液构成的原电池中负极材料为Mg
C.无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分
D.H2—O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2-
3.将铝片和镁片用导线连接后插入盛有NaOH溶液的烧杯中组成原电池,下列说法中正确的是
A.镁为负极,有Mg(OH)2生成 B. 铝为负极,有NaAlO2生成
C.镁为正极,镁片上有气泡产生 D. 铝为正极,铝片质量不变
4.用惰性电极电解1L足量KCl的溶液,若通过n mol电子的电量,则溶液的PH与n的关系是(设电解前后溶液的体积不变)
A.PH=n B.PH=-lgn C.PH=14-lgn D.PH=lgn+14
5、在盛有饱和Na2CO3溶液的烧杯中插入惰性电极进行电解,若温度始终不变,则通电一段时间后,下列说法中不正确的是( )
A、溶液的PH值不变 B、溶液中Na2CO3的物质的量不变
C、Na2CO3溶液的浓度不变,水解程度不变
D、溶液中水分子数与![]() 的比值将变小
的比值将变小
6.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I―==2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是
A.2I―-2e-==I2 碘遇淀粉变蓝 B.Cu-2e-==Cu2+ Cu2+ 显蓝色
C.2Cu+4I--4e-==2CuI↓+I2 碘遇淀粉变蓝
D.4OH― –4e-==2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
7.若某装置中发生如下反应,Cu+2H+======Cu2++H2↑,关于该装置的有关说法正确的是
A、该装置一定为原电池 B、该装置可能为电解池
C、若为原电池,Cu为正极 D、电解质溶液可能是硝酸溶液
8.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
9、某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A.阴极自始自终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
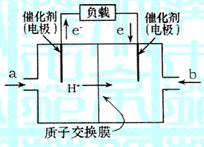
10.右图是2004年批量生产的笔记本电脑所用甲醇燃料电
|
和电子,电子经外电路、质子经内电路到达另一极与
氧气反应,电池总反应为:2CH3OH+3O2 2CO2+
4H2O。下列说法正确的是 ( )
A.右电极为电池的正极,b处通入的物质是空气
B.左电极为电池的负极,a处通入的物质是空气
C.正极反应式为:CH3OH+H2O-6e- CO2+6H+
D.负极反应式为:O2+4e- 2O3-
11、我国首创的铝—空气—海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是
① Fe-2e-===Fe2+ ②Al-3e- ===A13+ ③O2+2H2O+4e- ===4OH-
④4Al+3O2+6H2O===4Al(OH)3 ⑤2Fe+O2+2H2O===2Fe(OH)2
A.②③④ B.①③⑤ C.①⑤ D.③④
12、燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱。下面关于甲烷燃料电池的说法正确的是
A、负极反应为:O2+2H2O+4e →4OH-; B、负极反应为:CH4+10OH- - 8e→CO32-+7H2O
C、放电时溶液中的阴离子向负极移动; D、随放电的进行,溶液的pH值不变
13、镍—镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电极反应是:Cd + 2OH- -2e= Cd(OH)2,2NiO(OH) + 2H2O + 2e = 2Ni(OH)2 + 2OH-。下列说法不正确的是
A、电池放电时,电池负极周围溶液的pH不断增大;
B、电池的总反应式是:Cd + 2NiO(OH) + 2H2O = Cd(OH)2 + 2Ni(OH)2
C、电池充电时,镉元素被还原; D、电池充电时,电池正极和电源的正极连接。
14、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气。有关此电池的推断正确的是
A、负极反应为14 H2O+7O2+28e—=28 OH— B、放电一段时间后,负极周围的pH升高
C、每消耗1mol C2H6,则电路上转移的电子为14mol
D、放电过程中KOH的物质的量浓度不变
15.生物体中细胞膜内的葡萄糖与细胞膜外的富氧体液及细胞膜构成原电池,下列有关电极反应及产物的判断正确的是( )B
A.负极反应可能是O2+2H2O+4e→4OH--
B. 负极反应的产物主要是C6H12O6被氧化成CO32-- HCO3--和H2O
C.正极反应可能是C6H12O6+24OH---24e→6 CO2↑+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2 HCO3--和H2O
16.设NA为阿伏伽德罗常数的值,下列叙述中正确的是
A、lmolO2-含有的电子数为17NA
B、电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA
C、常温常压下,32g![]()
![]() 中所含的中子数为20NA
中所含的中子数为20NA
D、工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜小于0.5 NA
17、 设计出燃料电池使汽油氧化直接产生电流是对世纪最富有挑战性的课题之一。
最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1) 以丁烷代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2) 这个电池的正极发生的反应是:
负极发生的反应是:
固体电解质里的O2-的移动方向是:
向外电路释放电子的电极是:
答案:(1) 2C4H10+13O2 =8 CO2+10 H2O (2)O2+4e=2 O2–
C4H10+13O2– –26e=4 CO2+5 H2O 向负极移动; 负极。
18.室温下为液态的金属是 (填汉字名称)。电解它的一价金属的硝酸盐溶液时,阴极得到的产物是该金属的单质。当阴极消耗2mol该盐的正离子时,阳极可得1mol的气体产物,则此气体的产物是 (填分子式)。由此可推断得知该盐的化学式是 (填化学式)。其阴极上所发生的还原反应方程式是 :
19.科学家P.Tatapudi等人首先使用在酸性条件下电解纯水的方法制得臭氧。臭氧在_____极周围的水中产生,其电极反应式为_________________:在_______极附近的氧气则生成过氧化氢,其电极反应式为________________.电解的化学方程式为__________
答案:阳、3H2O-6e-=O3+6H+ 、阴、3O2+6H++6e-=3H2O2 3H2O+3O2=O3+3H2O2
20.(8分)在T℃时,取一定量食盐的饱和溶液用惰性电极进行电解,当阳极析出2.24L气体(标准状况)时,食盐完全电解,所得溶液的质量为36.9 g ,并测得其密度为1.20g/cm3,试计算:
(1) 电解后溶液中溶质的物质的量浓度?6.5mol/L
(2) T℃时食盐的溶解度是多少?36g