高三化学秋学期期末考试试卷
高三化学
注意事项:1、本试卷总分150分,考试时间120分钟
2、可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Mg-24 Ca-40 Cu-64 Ag-108
3、请将选择题的正确答案填写在选择题的答案栏里
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2008夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品和食品全都是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
2.下列化学用语正确的是
A.碳-12原子 ![]() B.羟基的电子式 ∶
B.羟基的电子式 ∶![]() ∶H
∶H
C.硫离子的结构示意图![]() D.乙烯的结构简式CH2CH2
D.乙烯的结构简式CH2CH2
3.下列叙述正确的是
A.12C与13C互为同素异形体
B.高级脂肪酸的甘油酯不是高分子化合物
C.Cl2属于非电解质
D.常温下Fe、Al与浓H2SO4不反应
4.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是
2AlN+3CO。下列叙述正确的是
A.氮化铝晶体属于分子晶体
B.氮化铝中氮元素的化合价为-3
C.上述反应中生成2mol AlN时,N2得到3mol电子
D.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
5.下列关于化学实验及应用的叙述正确的是
①配制500mL 0.1mol·L-1的NaCl溶液选用两只250mL的容量瓶
②向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
③吉林石化厂泄漏到松花江水域的苯、硝基苯可用活性炭吸附
④将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液的pH
⑤向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
A.①② B.②③ C.①②③⑤ D.②③④⑤
6.下列离子方程式正确的是
A.向澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
B.Cu与浓HNO3反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.实验室制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.Na投入水中:Na+2H2O=Na++2OH-+H2↑
7.下列关于阿伏加德罗常数(NA)的说法正确的是
A.1L 0.1mol·L-1的醋酸溶液中有0.1NA个CH3COOH分子
B.标准状况下,11.2L苯所含分子数为0.5NA
 C.3.2g铜与足量稀硝酸反应过程中转移电子0.1NA
C.3.2g铜与足量稀硝酸反应过程中转移电子0.1NA
D.6g二氧化硅中含Si-O键数为0.2NA
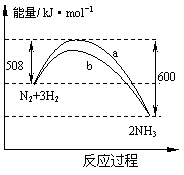
8.右图是198K时N2与H2反应过程中能量变化的
曲线图。下列叙述正确的是
A.该反应的热化学方程式为:
N2+3H2
![]() 2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.加入催化剂可增大正反应速率,降低逆反应速率
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.下列关于工业制H2SO4的说法错误的是
A.硫酸厂靠近原料产地的比靠近消费中心更为有利
B.接触法制硫酸的主要步骤是造气、接触氧化和三氧化硫的吸收
C.为了提高SO2转化率,常在SO2接触氧化时采用高压的反应条件
D.为了提高SO3的吸收效率常用浓H2SO4吸收SO3
10.下列溶液中,能大量共存的离子组是
A.pH=7的溶液:Na+、Fe3+、Cl-、SO42-
B.c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
C.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
11.有X、Y、Z三种主族元素,已知最高价氧化物的水化物的酸性强弱顺序是:
H3XO4<H3YO4<H3ZO4。下列推断正确的是
A.元素的非金属性:X>Y>Z
B.原子序数:X>Y>Z
C.气态氢化物的稳定性:XH3>YH3>ZH3
D.气态氢化物的还原性:XH3>YH3>ZH3
12.将0.2mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是
A.c(HCN)<c(CN-)
B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-)
D.c(HCN)+ c(CN-)=0.1 mol·L-1
13.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
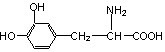 下列关于L-多巴的叙述中错误的是
下列关于L-多巴的叙述中错误的是
A.能与FeCl3溶液发生显色反应 B.能与乙酸发生酯化反应
C.能与溴水发生取代反应 D.1mol L-多巴最多可以和3mol NaOH反应
14.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是
A.负极反应为14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.放电过程中,K+向正极移动
D.理论上消耗1mol C2H6,电路上转移的电子为14mol
15.在一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g),
2HI(g),
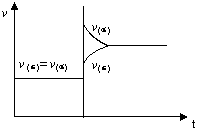 △H<0。当达到平衡后,改变反应的某一条件(不
△H<0。当达到平衡后,改变反应的某一条件(不
再充任何气体)造成容器内压强增大。下列说法正
确的是
A.容器内气体颜色变深,平均相对分子质量增大
B.平衡不移动,混合气体密度不变
C.平衡向右移动,HI浓度增大
D.反应速率变化如右图所示
16.某研究性学习小组为了证明NaOH溶液能使酚酞试液变红是OH-的性质,设计了如下方案,其中不可行的是
A.取KOH、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaCl、Na2SO4溶液分别与酚酞试液作用,观察溶液颜色
C.向滴有酚酞的20.0 mL 0.10 mol·L-1NaOH溶液中,逐滴加入25.0mL0.10 mol·L-1 的盐酸,观察溶液颜色变化
D.向滴有酚酞的25.0mL 0.10 mol·L-1盐酸中,逐滴加入20.0mL 0.10 mol·L-1的NaOH溶液,观察溶液颜色变化
选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、(本题包括2小题,共21分)
17.(8分)工业“从海水中提取镁”的流程图如下:
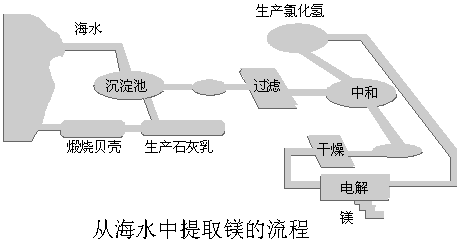
其步骤为:
① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④ 将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤ 电解熔融的氯化镁可得到Mg。
请回答以下问题:
⑴步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
⑵步骤④中的“一定条件”指的是 ,目的是 。
⑶上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
⑷有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。
理由是
。
18.(13分)某化学小组在实验室用下图提供的仪器制备溴乙烷。

已知:
①反应原理:NaBr+H2SO4(较浓)![]() NaHSO4+HBr
NaHSO4+HBr
HBr+C2H5OH C2H5Br+H2O
C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
| 密度/g·mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
回答下列问题:
⑴若烧瓶内液体的体积不小于烧瓶容积的![]() 且不大于
且不大于![]() ,则反应装置中,烧瓶容积最合适的是 (填序号)。
,则反应装置中,烧瓶容积最合适的是 (填序号)。
A.50mL B.150 mL C.200 mL
⑵连接上述仪器的顺序是:1接( )接( )接( )接( )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
⑶根据反应原理水不是反应物,那么在反应物中加水的目的是
①
②
⑷粗制溴乙烷常呈黄色,是因为溴乙烷中混有 ,除去该杂质的试剂和方法是 。
⑸请你设计实验证明溴乙烷中含有溴元素
。
四、(本题包括2小题,共19分)
19.(12分)下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
| ③ | ④ | ||||||||||||||||
| ① | ⑤ | ⑥ | |||||||||||||||
| ② | |||||||||||||||||
(1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(2)元素③氢化物的电子式为 ,其空间构型为 。
(3)元素④的氢化物沸点比元素⑤的氢化物沸点 (填“高”或“低”)。
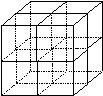 (4)元素①和元素⑥形成的化合物是
晶体(填晶体类型),右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素①和元素⑥所在位置。
(4)元素①和元素⑥形成的化合物是
晶体(填晶体类型),右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素①和元素⑥所在位置。
(5)元素①②形成的合金通常情况下呈 态,可作为 。
20.(7分)下图是中学化学中常见物质的转化关系图。已知:
(a)B、C、F为单质,其余为化合物;
(b)A常温下为无色液体;
(c)反应①②③均在高温条件下进行,其中①③是化工生产中的重要反应。
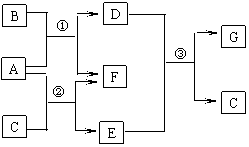 请按要求填空:
请按要求填空:
⑴G的电子式 ;
E的化学式 。
⑵反应①的化学方程式
。
该反应在工业上的重要意义在于使固体燃
料气体化,这样做的优点是
, 。
五、本题包括1小题,共11分)
21.(11分)人们一刻也离不开空气,大气污染影响着人们的正常生活。改善空气质量,保持空气清新,营造健康舒适的生存环境,已成为全人类的共识。
(1)下面是我国上海地区第一份空气质量预报表。
上海市空气质量预报 1999年6月5日
| 指 标 | 昨 日 实 况 | 今 日 预 测 | ||
| API | 空气质量等级 | API | 空气质量等级 | |
| 总悬浮颗粒物 | 26 | Ⅰ | 20-35 | Ⅰ |
| 二氧化硫 | 38 | Ⅰ | 30-45 | Ⅰ |
| 氮氧化物 | 59 | Ⅱ | 55-75 | Ⅱ |
| 说 明 | 预计今日空气质量较好,对人体无不利影响,市民可正常活动。 | |||
①试简述空气质量预报对有关部门和普通市民各有哪些指导意义?
对有关部门 ,
对普通市民 。
②二氧化硫是污染大气的主要有害物质之一。除去SO2的方法有多种,其中有一种方法叫“石灰石脱硫”法,原料为石灰石,产品为石膏。请写出相关的化学方程式: 。
(2)一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为
2C8H18+23O2![]() 12CO2+4CO+18H2O
12CO2+4CO+18H2O
①某环境监测兴趣小组的同学描绘的无锡市市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是( )
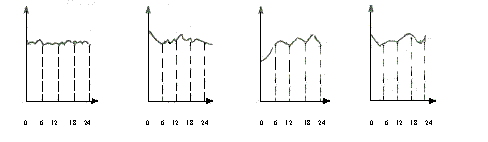 |
A B C D
②为了解决机动车污染空气的问题,你有何建议?(提2条)
。
(3)据《南京零距离》报道,有一公司刚开张几天,员工却全体出现中毒症状,但空气检测部门检测各项指标均合格。专家发现是地毯出了问题。原来地毯厂为了防止地毯中甲醛超标,先用漂白粉对地毯进行了处理,结果消除了甲醛却放出了氯气。请你写出该过程的离子方程式 。
六.(本题包括2小题,共18分)
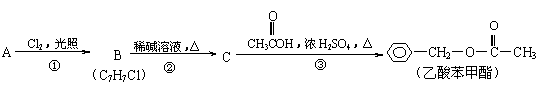 22.(8分)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。
22.(8分)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。
⑴A的结构简式为
⑵①②③三个反应中,属于取代反应的是
⑶写出反应③的化学方程式
⑷乙酸苯甲酯有多种同分异构体,苯环上只有一个取代基的酯的同分异构体只有五种,其中两种的结构简式是
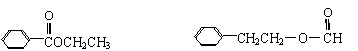 |
请写出另外三种同分异构体的结构简式:
, , 。
23.(10分)目前用于抗幽门螺旋杆菌的常见高效抗生素是氨苄青霉素,它可由青霉素来合成。
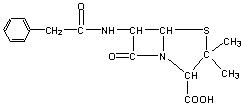
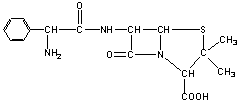
青霉素(C16H18N2O4S) 氨苄青霉素(C16H19N3O4S)
![]()
已知:…-C-NH-…+H2O
![]() …-C-OH+H2N-…
…-C-OH+H2N-…
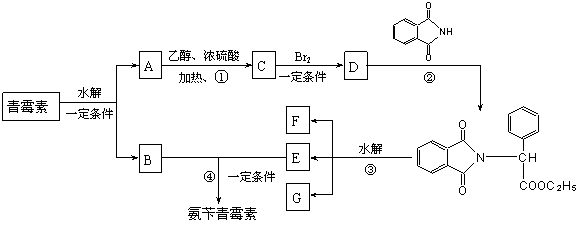 下图是青霉素制取氨苄青霉素的合成路线:
下图是青霉素制取氨苄青霉素的合成路线:
请回答下列问题:
⑴写出反应①②③④的反应类型
① , ② , ③ , ④ 。
⑵写出D的结构简式 。
⑶写出反应①③的化学方程式:
① ,
③ 。
七.(本题包括2小题,共17分)
24.(8分)取19.80g MgCl2和CaCl2的混合物溶于水,加入210.00mL 2mol·L-1 AgNO3溶液,充分反应后过滤,在滤液中加入质量为10.00g的铜片,充分反应后取出铜片,经洗涤干燥后称得质量为11.52g。求原混合物中CaCl2的质量分数。
25.(9分)维生素C(C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6+I2=C6H6O6+2HI。
现欲测定某样品中维生素C的含量,实验步骤:取10mL 6mol·L-1CH3COOH溶液,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷的溶液中。加入1mL指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定。实验测得的数据如下表。
| 滴定次数 | 标准碘溶液体积/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.24 | 25.25 |
| 2 | 0.10 | 21.18 |
| 3 | 0.00 | 20.92 |
试回答下列问题:
⑴滴定时所用指示剂是 。
⑵为何加入的CH3COOH溶液要经煮沸、冷却后才能使用?
⑶计算样品中维生素C的质量分数。
高中期末考试评分标准
高三化学
一、单项选择题(每小题4分,共32分。)
1.A 2.C 3.B 4.B 5.B 6.A 7.C 8.B
二、不定项选择题(每小题4分,共32分。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.AC 10.C 11.BD 12.BD 13.B 14.CD 15.D 16.D
三、(本题包括2小题,共21分)
17.(8分)⑴蒸发皿(1分),玻璃棒(1分)
⑵在HCl气流中(1分),抑制MgCl2水解成Mg(OH)2(1分)
⑶电解产生的Cl2用于制取HCl气体(1分)
⑷不同意(1分)。
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本(2分)
18.(13分)⑴B(2分)
⑵1 6 5 4 3 2 (1分);烧杯(1分)
⑶①稀释浓硫酸,降低其氧化性,减少副产品溴的生成;(1分)
②溶解HBr,防止HBr大量逸出,影响产品的生成。(1分)
⑷Br2(1分); NaOH溶液(1分),分液取下层(1分)
⑸取分液后的产品少量,加NaOH溶液加热(1分),在加热后的溶液中加HNO3使其呈酸性(1分),再向其中滴加AgNO3(1分)。若有沉淀生成,证明C2H5Br生成。(1分)
四、(本题包括2小题,共19分)
19.(12分)(1)(2分+2分)
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
| ③ | ④ | ||||||||||||||||
| ① | ⑤ | ⑥ | |||||||||||||||
| ② | |||||||||||||||||
 (2)
(2)![]() (1分),三角锥形(1分)
(1分),三角锥形(1分)
(3)高(1分)
(4)离子晶体(1分) 结构图(2分)
(5)液态(1分),原子反应堆的导热剂(1分)
20.(7分)(1)![]() (2分),Fe3O4(1分)
(2分),Fe3O4(1分)
(2)C+H2O![]() CO+H2(2分)
CO+H2(2分)
提高燃料的利用率(1分),气化过程中脱硫减少SO2的污染(1分)(或便于输送)
五、(本题包括1小题,共11分)
21.(11分)(1)①督促政府加强环保措施,增强政府工作透明度(1分),
增强环保意识,给市民生活提供指导(1分)
②CaCO3![]() CaO+CO2↑,CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4(3分)
CaO+CO2↑,CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4(3分)
(2)①C(2分) ②控制机动车数量;改变机动车燃料,例如用太阳能或燃烧电池;改变机动车结构,使燃烧充分;增加机动车尾气吸收装置(2分)
(其他合理答案也可)
(3)HCHO+4ClO-+4H+=CO2↑+2Cl2↑+3H2O(2分)
六、(本题包括2小题,共18分)
![]() 22.(8分) (1) —CH3 (1分)
22.(8分) (1) —CH3 (1分)
(2)①②③(2分)
|
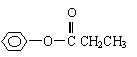
(4) (1分), (1分)
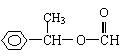 |
(1分)
23.(10分)⑴①酯化(取代) ②取代 ③水解(取代) ④取代(每格1分)
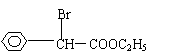 |
⑵ (2分)
⑶① (2分)
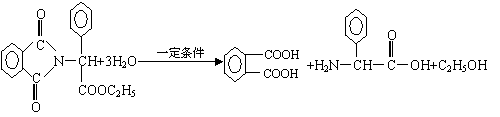 ③(2分)
③(2分)
七.(本题包括2小题,共17分)
24.(8分)28.03%
计算出与Cu反应的n(Ag+)=0.02mol(2分)
MgCl2和CaCl2中n(Cl-)=0.40mol(2分)
n(CaCl2)=0.05mol (2分)
CaCl2的质量分数 28.03%(2分)
25.(9分)(1)淀粉溶液(2分)
(2)煮沸是为了除去溶液中溶解的O2,避免维生素C被O2氧化(1分);
冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速率(1分)
(3)数据处理(取第2第3次滴定体积求平均值,1分)
计算出维生素C的质量m(Vc)=0.1848g(2分) 92.40%(2分)