高三化学第一学期期末考试试卷
考生注意:本试卷包括Ⅰ卷(选择题)和Ⅱ卷(非选择题)。满分100分
可能用到的相对原子质量:H—1 C—12 O—16 Mg—24 Cl—35.5 Cu—64。
第Ⅰ卷(选择题 共44分)
一、选择题:(本题共18小题,每小题只有一个选项符合题意,1—10小题,每题2分,11—18小题,每题3分,共44分。请将正确选项填写在第5页卷首表格中。)
1.下列叙述正确的是
A.目前加碘食盐中主要添加的KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品是不含化学物质的食品
D.空气质量日报中CO2含量属于空气污染指数
2.下列选项与胶体知识无关的是
A.在豆浆里加入盐卤做豆腐
B.水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染
C.一束平行光线照射暗箱中的蛋白质溶液时,从侧面可以看到光亮的通路
D.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
3.下列关于电解质知识的叙述,正确的是
A.Cl2 的水溶液能导电,但Cl2 是非电解质
B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.给pH=12的NaOH溶液通电一段时间后溶液的pH > 12
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
4.下列各组物质气化或熔化时,所克服的粒子间的作用力属于同种类型的是
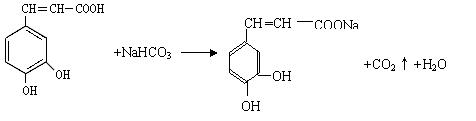
A.二氧化硅和生石灰的熔化 B.氯化钠和铁的熔化
C.碘和干冰的升华 D.氯化铵受热气化和苯的气化
5.下列说法正确的是
A.100 mL 2.0 mol/L 的氯化铜溶液中铜离子个数为0.2×6.02×1023
B.1mol烷烃(CnH2n+2)含有的共价键数目为(3n+1)×6.02×1023
C.标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023
D.24g镁在足量CO2中燃烧转移的电子数目为4×6.02×1023
6.在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
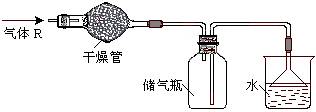
A.O2 B.Cl2
C. NH3 D.CO2
7.下列各组离子一定能大量共存的是
A.在强碱溶液中:Na+、K+、AlO2-、CO32-
B.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
C.在c(H+) =10-13mol/L 的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH =1的溶液中:K+、Fe2+、Cl-、NO3-
8.下列反应的离子方程式正确的是
A.碳酸氢铵溶液与足量氢氧化钠溶液反应 + OH-NH3·H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全
2Al3++ 3SO42-+ 3Ba2++ 6OH-2Al(OH)3↓+ 3BaSO4↓
C.乙醛与银氨溶液在热水浴中的反应
CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量的CO2
2C6H5O-+CO2 +H2O→2C6H5OH+CO32-
9.下列事实中,能用同一化学原理解释的是
A.氯气和二氧化硫都能使品红溶液褪色
B.二氧化硫和乙烯都能使溴水溶液褪色
C.二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色
D.大量Na2SO4和甲醛都能使蛋白质从溶液中析出
10.下列排列顺序正确的一组是
A.粒子半径:Fe(OH)3胶粒>I->Na+>F- B.氧化性:MnO4->Cl2>Fe3+>Zn2+
C.酸性:H3PO4<H2CO3<H2SiO4<H2SO4 D.热稳定性:NaHCO3<Na2CO3<CaCO3<Al2O3
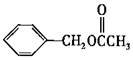 11.乙酸苯甲酯的结构简式如右图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种
11.乙酸苯甲酯的结构简式如右图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种
A.3 B.4 C.5 D.6
12.下面是某学生利用数据分析的情况,其中不正确的是
A.根据气体的相对分子质量,可以比较相同状况下气体密度的大小
B.根据甲烷和乙烷的熔点,可以比较二者晶体中的分子间作用力的大小
C.比较同周期金属元素原子半径的大小,可以推断元素的金属性强弱
D.根据溶液的温度大小,可以判断物质的溶解度大小
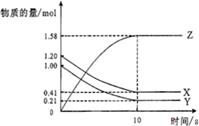 13.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述错误的是
13.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述错误的是
A.达到平衡所需要的时间是10s
![]() B.平衡时Y的转化率为79.0%
B.平衡时Y的转化率为79.0%
C.该反应的化学方程式为 X(g)+Y(g) 2Z(g)
D.前10s,用Z表示的反应速率为0.79mol/(L·s)
14.奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构如右图),
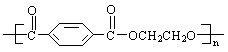 下列说法正确的是
下列说法正确的是
A.羊毛与聚酯纤维的化学成分相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇 D.聚酯纤维和羊毛都属于合成纤维常温时,将15.a1 mL b1 mol/L 的CH3COOH溶液加入到a2 mL b2 mol/L 的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
16.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.T的氢化物沸点高于Q的氢化物沸点 B.L、M的单质与稀盐酸反应速率:M > L
C.T、Q的氢化物常态下均为无色气体 D.L、Q形成的简单离子核外电子数相等
17.下列实验 操作不合理的是
①用FeCl3溶液鉴别乙醇溶液和苯酚溶液
②用溴水检验汽油中是否含有不饱和脂肪烃
③用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
④仅用蒸馏水鉴别蔗糖、硫酸铜粉末、碳酸钙粉末
⑤用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH
⑥配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
⑦在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
A.①⑤⑥ B.④⑦⑧ C.②④⑤⑧ D.①④⑦
18.有X、Y、Z、W 四种金属进行如下实验:
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 2 | 将X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实的下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入 CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸构成的原电池,X做负极
第Ⅰ卷(选择题 44分)
一、请将选择题正确选项填写在下列表格中,每小题只有一个选项符合题意。(本题共18小题,每题只有一个选项符合题意,1—10小题,每题2分,11—18小题,每题3分,共44分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共56分)
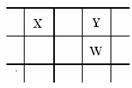 19.(12分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
19.(12分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
(1)五种元素形成的单质,其中,固态时属于原子晶体的是: (填化学式);
常用做强氧化剂的是 、 (填化学式)。
(2)这五种元素中,原子半径最大的是: (填化学式);
由Z、W、Q形成的简单离子半径由大到小的顺序是: (用化学式表示);X、W、Q最高价氧化物的水化物酸性从强到弱的顺序是: (用化学式表示);
(3)Z与Q反应生成的化合物属于 化合物;电解该化合物的饱和溶液,阳极的电极反应式为: ;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。
(4)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9g该化合物燃烧放出140 kJ的热。
写出该化合物燃烧热的热化学方程式: 。20.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
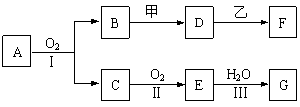 |
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 (填设备名称)中进行,工业上反应Ⅲ用于吸收E的试剂是 。
②D的水溶液呈 性(填“酸”、“碱”或“中”)。
③反应Ⅰ的化学方程式是______________________________________________ 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出甲物质的电子式是 。
②写出D到F的反应化学方程式是______________________________________。
③把盛满E物质的烧瓶封闭后放在冰水中冷却,一会儿观察到的现象是 。
反应的化学方程式是____________________________________ 。
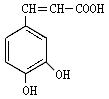
21.(14分)咖啡酸( )也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野
胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是
(2)咖啡酸不具有以下哪些性质
A.在浓硫酸、加热条件下能发生消去反应
B.能与FeCl3发生显色反应
C.能发生银镜反应
D.一定条件下能发生酯化反应
(3)1mol咖啡酸与浓溴水反应时最多消耗 mol Br2,
反应类型有 ;
(4)咖啡酸一定条件下发生加聚反应的方程式
,
咖啡酸与NaHCO3溶液反应的方程式
。
(5)有机物A分子式为C9H10O2,A分子中含有一个甲基,A能发生水解反应,在溶液中1molA能与2molNaOH反应,写出符合上述条件的有机物A的结构简式 。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成y g H2O和m L CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式 。
22.(11分)右图中X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
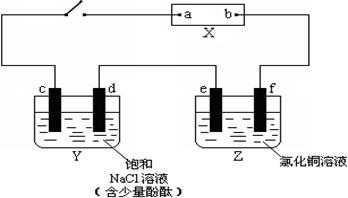
(1)①电源上b为 极。(用“正”、“负”、“阴”、“阳”填空)
②Z槽中e为 极(同上)。
③连接Y、Z槽线路中,电子流动的方向是d e(用“→”和“←”填空)。
(2)①写出c极上反应的电极反应式 。
②写出Y槽中总反应化学方程式 。
③写出Z槽中e极上反应的电极反应式 。
(3)①电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为 mol
②若Y槽中溶液体积为500mL(电解后可视为不变),则槽中单位时间内氢氧根离子浓度的变化是 mol/(L.min)。
23.(8分)某化学课外小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________ 。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________
。
⑷为了使步骤2中的含铝离子沉淀完全,还可以应用的最佳试剂是____________ 。
高三化学答案
第Ⅰ卷(选择题 共44分)
一、选择题:(本题共18小题,每题只有一个选项符合题意,1—10小题,每题2分,11—18小题,每题3分,共44分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | C | C | B | C | A | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | D | D | B | C | A | B | C |
第Ⅱ卷(非选择题 共56分)
19.(共12分)
(1)C; O2 、 Cl2 (每空1分 共3分)
(2)Na;S2->Cl- >Na+ ;HClO4>H2SO4>H2CO3 (每空1分 共3分)
(3) 离子;2Cl- -2e- = Cl2↑ (每空1分 共2分) Cl2 + 2OH- = Cl- + ClO- + H2O(2分)
(4)C6H12O6 (s) + 6O2(g) =6 CO2(g) + 6H2O(l);△H=-2800kJ/mol (2分)
20.(共11分)
(1)①接触室 98.3%浓硫酸 ②酸性 (每空1分 共3分)
|
③4FeS2+11O2=====8SO2+2Fe2O3 (2分)
(2)①Na2O2 略(1分) ②2Al+ 2NaOH+2H2O = 2NaAlO2 + 3H2↑(2分)
![]()
③ 颜色变浅 (1分) 2NO2 N2O4 (2分)
21.(14分)
(1)C9H8O4 (1分)
(2)A、C(2分,见错不得分)
(3)4 (1分) 加成反应和取代反应 (2分 见错不得分)
(4)
n
(每个方程式2分,共4分 缺条件和↑扣1分)
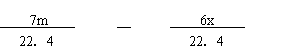
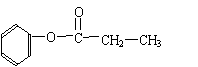 (5)
(2分)(6)
(5)
(2分)(6)
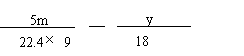
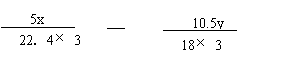
或 或 (2分)
22.(11分)
(1)①负 ②阳 ③← (每空1分 共3分)
(2)①2Cl--2e-= Cl2↑ (2分)
②2NaCl + 2H2O![]() 2NaOH
+ H2↑+ Cl2↑
(2分)
2NaOH
+ H2↑+ Cl2↑
(2分)
③Cu-2e-= Cu2+ (2分)
(3)①0.02 ②0.02 mol/(L·min) (每空1分,共2分)
23.(本题8分)
(1) 烧杯 漏斗 (各1分,共2分) (2)除去铁等不溶于碱的杂质(2分)
(3)取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全 (2分)
(4)通入足量的CO2气体 (2分)