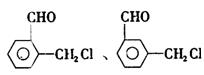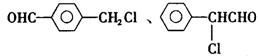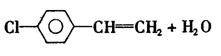高三化学第一学期期末考试试卷
高三化学试卷
(考试时间90分钟,满分100分)
说明:
1. 本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,答题前,考生务必将自己的班级、姓名、座号填写在试卷指定位置。
2. 答案写在各题指定的答题处。
本卷可能用到的相对原子质量如下:H:1 O:16 C:12 Cu:64 Mg:24 Ba:137 Fe:56
N:14 Al:27 S:32
第Ⅰ卷 选择题(共44分)
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案):
1、近日我国公布了第111号元素(Rg)的中文名称,下列关于![]() 的说法不正确的是 A.中子数是161 B.电子数是111
的说法不正确的是 A.中子数是161 B.电子数是111
C.质量数是272 D.质子数是161
2、下列实验装置图完全正确的是 ( )

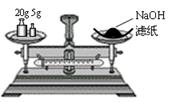
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
| |
3.下列反应的离子方程式书写正确的是
A.醋酸钠的水解反应 CH3COO—+H3O+=CH3COOH+ H2O
B.碳酸氢钙与过量的NaOH溶液反应
Ca2++2HCO3—+2OH—=CaCO3↓+ 2H2O+ CO32—
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
D.浓烧减溶液中加入铝片:Al + 2OH-=AlO2-+H2↑
4.在由水电离产生的OH—浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、C6H5O-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、AlO2- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
5.NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B 常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5g SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
|
|
A.X的化学式为C8H8
|
C.X能使酸性的高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
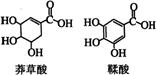 7、莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
7、莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A 两种酸都能与溴水反应
B 两种酸遇三氯化铁溶液都显色
C 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D 等物质的量的两种酸与足量金属钠反应产生氢气的量不同
8.下列说法正确的是 ( )
①SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
②一般电解质溶液导电过程就是该溶液的电解过程;
③双氧水、二氧化硫既有还原性又有氧化性;
④NaCl、CsCl两晶体阴阳离子排列方式一样;⑤KNO3属于纯净物,又属于复合肥;
⑥离子化合物的熔点一定比共价化合物的高
⑦Fe(OH)3、FeCl2都不能用直接化合法来制取;
A.②③⑤ B.①④⑥ C.②③⑦ D.②⑤⑦
9、短周期元素A、B、C原子序数依次增大,A、C同主族,B原子的最外层电子数等于A原子最外层电子数的一半,且三种元素原子的最外层电子数之和为15。下列叙述正确的是
A.常温下B单质不与A单质反应
B.工业上采用热还原法冶炼B
C.A的氢化物的沸点高于C的氢化物
D.B是氧化物只能溶于酸
10.下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
二、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确答案)
11.对在室温下,pH相同、体积相同的氨水和氢氧化钠溶液,采取下列措施后,有关叙述正确的是 ( )
A.温度下降20℃,两溶液的pH均不变
B.各加水稀释10倍,两溶液的pH仍相等
C.分别加入适量的氯化铵晶体,两溶液的pH均减小
D.各用相同物质的量浓度的盐酸中和,所消耗盐酸的体积相等
12.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是 ( )
A.常温条件下,酚酞的变色范围:![]()
B.HCl和NaAlO2溶液反应后铝元素的存在形式:
![]()
C.CO2通入澄清石灰水中反应的产物:![]()
D.分散系的分类:![]()
13.乙醇汽油是用普通汽油与燃料乙醇调和而成,它可以有效改善油的性能和质量,降低一氧化碳、碳氢化合物等主要污染物的排放。乙醇的燃烧热是23.5 kJ·mol-1,燃烧1 mol这种乙醇汽油生成液态水,放出的热量为Q kJ。测得该汽油中乙醇与汽油的物质的量之比为1:9。有关普通汽油(CxHy)燃烧的热化学方程式正确的一项是( )
A.CxHy(l)+(x+y/4)O2(g)===xCO2(g)+y/2H2O(l);ΔH=(—Q+23.5) kJ·mol-1
B.CxHy(l)+(x+y/4)O2(g) ===xCO2(g)+y/2H2O(l);ΔH=(—10Q/9+2.61) kJ·mol-1
C.CxHy(l)+(x+y/4)O2(g) ===xCO2(g)+y/2H2O(l);ΔH=—9Q/10 kJ·mol-1
D.CxHy(l)+(x+y/4)O2(g)===xCO2(g)+y/2H2O(g);ΔH=—9Q/10 kJ·mol-1
14. 如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法错误的是
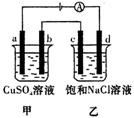 A. 乙烧杯中c极的电极反应为2Cl--2e-
A. 乙烧杯中c极的电极反应为2Cl--2e-![]() Cl2↑
Cl2↑
B. a、c两极产生气体的物质的量不相等
C. 甲、乙两烧杯中溶液的pH均保持不变
D. 甲烧杯中发生的反应为
2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
|
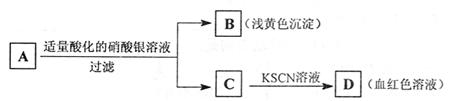
由此分析,下列结论中,正确的是 ( )
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
![]() 16.在等温等容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:(Ⅰ)A和B的起始浓度均为2mol/L;(Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
16.在等温等容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:(Ⅰ)A和B的起始浓度均为2mol/L;(Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,体系内各气体的体积分数相同
B.达到平衡时,Ⅰ途径混合气体密度为Ⅱ途径混合气体密度的2倍
C.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的各物质的量相同
D.达到平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vB
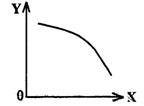
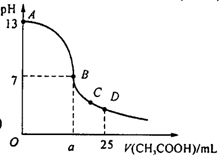 17.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
( )
17.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
( )
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有
c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= c(Na+)
18.某浓度的硝酸与过量铁粉反应时生成了4.48LN2O气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是( )
A.13.5g B.9g C.27g D.8.9g
第Ⅱ卷 非选择题(共56分)
19. (6分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)写出该反应的化学方程式。 。
若反应中生成0.2 mol HNO3,转移的电子数目为 个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2,NaF、H2O外。还肯定有 (填化学式)。
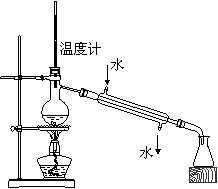
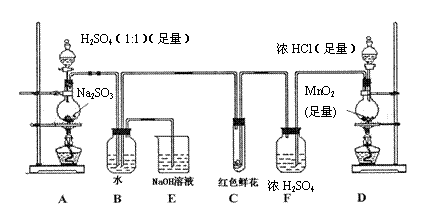 20、(10分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
20、(10分)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、 。
(2)实验开始后,写出B中反应的离子方程式 。
 (3)C中的现象是
,E装置的作用是
。
(3)C中的现象是
,E装置的作用是
。
(4)按右图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g,则原样品中Na2SO3的纯度为 (精确到0.1%)。
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将 (填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃 处酒精灯(填装置字母)。
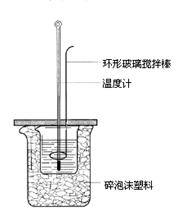
21.(11分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 。
实验室保存甲的方法是 。
|
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体
|
d.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(4)现有硫酸与甲的混合液20mL,其中硫酸的物质的量浓度为2mol·L—1,甲的物质的量浓度为1mol·L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明)
。
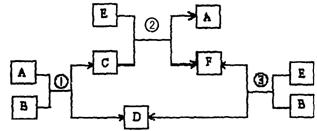
22.(11分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
|
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用字母表示) ,其中A的化学式是 。
(2)若B是某元素R的氢化物,B的沸点大于与R同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应①的化学方程式 ,③的化学方程式 。
(3)若B由短周期元素X、Y组成,且X、Y原子个数比为1:1,B晶体中既含有离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为 ,反应①的离子方程式 。在反应③中,若生成1mol D,则转移电子数目为 。
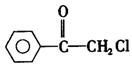
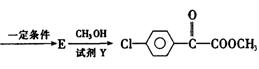
|
(1)苯氯乙酮可能发生的化学反应类型有 (选填字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
(2)同时符合①分子内有苯环但不含甲基:②氯原子与链烃基直接相连;③能发生银镜
|
、 。
|
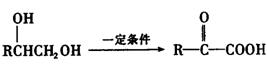
(3)已知:
苯氯乙酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂
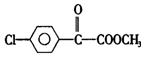
|
|
|
请回答:
①M的结构简式为 ,D中含氧官能团名称为 。
②A→B的化学反应方程式为 。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5C1,则该产物的结构简式为 。
24、本题有3小题,每题2分:
(1)若1 mol某烃充分燃烧耗氧6 mol,则此有机物的分子式为 。
(2)若4.4g某烃的衍生物完全燃烧生成8.8gCO2和3.6gH2O,则该有机物的实验式为
。
(3)若某烃的衍生物中,碳的质量分数为60.0%,氢的质量分数为13.33%,则该有机物的分子式为 。
|
|
|
|
题
|
| 名 姓
|
答 |
|
|
准
|
| 号 座
| 不
|
|
| 内
线
|
| 级 班
|
封
|
|
|
密
|
|
|
|
第一学期期末考试
高三化学答题卷
第Ⅰ卷 选择题(共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
一、选择题(每小题2分,共20分,每小题只有一个正确答案)
二、选择题(每小题只有一个正确答案,每题3分,共24分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共56分)
19. (6分)
(1) 。
(2) 。
个。
(3) 。
(4) (填化学式)。
20、(10分)
(1) 。
(2) 。
(3) , 。
(4) (精确到0.1%)。
(5) (填“偏高”、“偏低”或“无影响”)。
(6) (填装置字母)。
21.(11分)
(1) 。
(2) 。
。
(3) (选填字母)
(4) 。
(5) ,
。
22.(11分)
(1) , 。
(2) ,
③ 。
(3) , 。
。
23.(12分)
(1) (选填字母)。
(2)
、 。
(3)
① , 。
② 。
③ 。
24、(6分)本题有3小题,每题2分:
(1) 。
(2) 。
(3) 。
第一学期期末考试
高三化学评分标准
第Ⅰ卷 选择题(共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | B | B | D | D | A | A | C | D |
一、选择题(每小题2分,共20分,每小题只有一个正确答案)
二、选择题(每小题只有一个正确答案,每题3分,共24分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | B | C | B | A | C | A |
第Ⅱ卷(非选择题,共56分)
19. (6分)
![]() (1)1∶2 。(1分)
(1)1∶2 。(1分)
(2)3NF3+5 H2O 2 NO+HNO3+9 HF 。(2分)
0.4NA或2.408×1023个。(1分)
(3)产生红棕色气体、产生刺激性气味气体、产生白雾(写出1个即得分)。(1分)
(4)NaNO3 (填化学式)。(1分)
20、(10分)(1)圆底烧瓶、分液漏斗(2分)
(2)Cl2+SO2+2H2O=4H++2Cl-+SO![]() (2分)
(2分)
(3)红色鲜花褪色 吸收未反应的有毒气体,防止有毒气体对大气的污染(各1分)
(4)50.8% (2分)
(5)偏低 (1分)
(6)D (1分)
21.(11分)(1)略(2分)
(2)4HNO3 2H2O+4NO2↑+O2↑;(2分)贮存在棕色瓶中,置于冷暗处(1分)
(3)ab(2分)
(4)224mL(2分)
![]() (5)促进;(1分) NH4++H2O NH3·H2O+H+,破坏了H2O的电离平衡,使H2O的电离平衡正向移动(2分)
(5)促进;(1分) NH4++H2O NH3·H2O+H+,破坏了H2O的电离平衡,使H2O的电离平衡正向移动(2分)
22.(11分)(1)E>A>D;(1分)Br2;(1分)
(2)3Fe+4H2O Fe3O4+4H2;(2分)CO+H2O CO2+H2(2分)
(3)电子式略,(1分)2Na2O2+2H2O=O2↑+4Na++4OH—,(2分)2mol(2分)
23.(12分)(1)abd(2分)
|
(2) (各1分)
|
(3)① (各2分)
|
|
② (2分)
|
③ (2分)
24、(6分)本题有3小题,每题2分:
(1) C4H8
(2) C2H4O
(3) C3H8O