高三化学第一学期期末试卷
一、选择题(本题包括8小题。每小题2分,共16分。每小题只有一个选项符合题意)
1.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——二氧化碳 B.光化学污染——二氧化氮
C.酸雨——二氧化碳 D.臭氧层破坏——氟氯烃
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
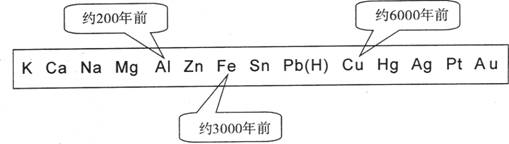
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
3.下列说法正确的是
A.标准状况下,由5.6LNO和5.6LO2组成的混合气体中原子总数约为6.02 ×1023
B.50mL0.1mol/LNaC1溶液中,微粒总数约为6.02 × 1021
C.1mol甲基中电子总数约为6.02×1024
D.22.4L乙炔中共用电子对总数约为1.806 ×1024
 4.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1molN-N吸收167kJ热量,生成lmolN≡N放出942kJ热量,由此判断下列说法正确的是
4.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1molN-N吸收167kJ热量,生成lmolN≡N放出942kJ热量,由此判断下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1molN4气体转变为N2将吸收882kJ热量
5.锌一锰干电池的总反应式为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,下列说法
错误的是
A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+
B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
6.某无色溶液中加入铝粉能产生氢气,则该溶液中肯定能大量共存的离子组是
A.Na+、NH4+、SO42-、NO3- B.Fe3+、Mg2+、Cl-、SO42-
C.Na+、K+、Cl-、SO42- D.K+、Na+、A1O2-、MnO4-
 7.喷墨打印机墨汁的pH为7.5~9.0。当墨汁喷在纸上时,与酸性物质作用生成不溶于水的固体。由此可知①墨汁偏酸性②墨汁偏碱性③纸张偏酸性④纸张偏碱性
7.喷墨打印机墨汁的pH为7.5~9.0。当墨汁喷在纸上时,与酸性物质作用生成不溶于水的固体。由此可知①墨汁偏酸性②墨汁偏碱性③纸张偏酸性④纸张偏碱性
A.①④ B.①③ C.②④ D.②③
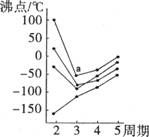
8.右图中每条折线表示周期表ⅣA~VIIA中的某一族元素氢化物的
沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.NH3 B.H2S C.SiH4 D.HF
二、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个
选项符合题意)
9.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁镑晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水。
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+。
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-。
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+。
10.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用下图表示:
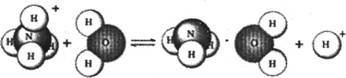
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
A.存在NH3·H2O,其结构式为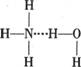 B.存在NH4+,其电子式为
B.存在NH4+,其电子式为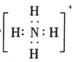
C.存在H3O+,其结构式为![]() D.存在OH-,其电子式为
D.存在OH-,其电子式为![]()
11.0.1MPa、500℃,将xL SO3通过装有V2O5的硬质玻璃管后,气体体积变为y L(气体体积均在同温同压下测定),该y L气体中SO3的体积分数是
![]()
![]()
![]()
![]()
12.下列离子方程式的书写正确的是
A.铜与三氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+
B.铝片溶于氢氧化钠溶液:2A1+2OH-+2H2O=2A1O2-+3H2↑
C.三氯化铝溶液中加入氨水:A13++3OH-=Al(OH)3↓
D.NH4HCO3溶液与足量的氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
13.元素周期表前四周期的元素中,同一周期的两种主族元素原子的核外电子数的差值不可能为
A.6 B.8 C.11 D.16
14.下列化合物中,可通过置换反应二步得到的是:①FeSO4 ②HCl ③Fe3O4 ④Mg(OH)2
A.①②④ B.①②③ C.①③④ D.①②③④
15.在0.1mol/L Na2CO3溶液中,下列关系式不正确的是
A.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L B.2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) D.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
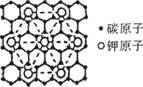
16.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳环中。比较常见的石墨间隙化合物是化学式为KCx的青铜色化合物,其平面图形如图。则x值为
A.g B.12 C.24 D.60
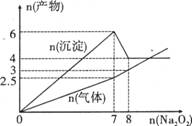
17.将Na2O2逐渐加入到含有A13+、Fe2+的混合液中,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mo1)的关系如图所示,则原溶液中A13+、Fe2+的物质的量分别为
A.4mol、2mol B.2mol、4mol D.1mol、2mol D.2mol、1mol
第II卷(共57分)
三、【本题包括2小题,共18分】
18.(4分)下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.用10mL的量筒量取4.80mL的浓硫酸
F.不慎接触过多的氨,及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛
19.(14分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力
菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
![]()
试回答下列问题:
(1)试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出
+2价Fe在空气中转化为+3价Fe的化学方程式 ;
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,
你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不
合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的
实验加以验证(若你认为合理,该空不要作答) 。
四、(本题包括2小题,共14分)
20.(6分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
(1)该反应中还原剂是 ;
(2)该反应中还原产物是 ;
(3)若反应过程中转移了0.3mol电子,则生成水的质量是 g。
21.(8分)在完全满足可逆反应:2H2O(g) ![]() 2H2+O2,2CO+O2
2H2+O2,2CO+O2![]() 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入l
L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入l
L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
(1)请在图中画出c(H2)随时间t的变化曲线图;
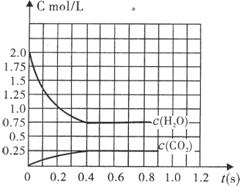 (2)平衡时c(O2)平为
mol/L。
(2)平衡时c(O2)平为
mol/L。
(3)欲计算出平衡时O2的浓度,除已知“H2O(g)
和CO”的物质的量外,至少需要知道平衡体
系中某两种气体的平衡浓度。这两种气体除
可以是H2O和CO2外还可以是 。
(4)在其它条件不变的情况下,若改为起始时在
容器中充入2molH2和2molCO2,则上述两反
应达到平衡时,c(O2)平= mol/L。
五、(本题包括2小题,共14分)
22.(7分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等。Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出元素的名称:A ,C 。
(2)Y分子是 分子(填极性和非极性)。
(3)写出实现下列转化的化学反应方程式并标明电子转移的方向和数目:
C2+(BA)n→A2
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式:
23.(7分)已知X是一种碱式盐,H是常见金属单质,F、I是常
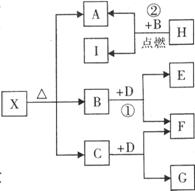 见非金属单质,E、G都是工业上重要的碱性物质,它们有右
见非金属单质,E、G都是工业上重要的碱性物质,它们有右
图所示的关系。
试回答下列问题:
(1)G的化学式为: 。
(2)写出下列反应的化学方程式
① ,
② 。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质
的量与消耗盐酸的物质的量之比为3:8,则X的化学
式为: 。
六、(本题包括1小题,共11分)
24.(11分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL0.6moL/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学方程式 ;
(2)产物中硝酸铜的物质的量 mol;
(3)如混合物中含0.01 molCu,则其中Cu2O、CuO的物质的量分别是 mol、 mol;
(4)如混合物中Cu的物质的量为X,则X的取值范围为 。
第一学期高三期末化学测试卷参考答案
一、选择题1.C 2.B 3.A 4.B 5.C 6.C 7.D 8.B(每小题2分,共16分)
二、选择题9.D IO.A 11.A 12.B 13.B 14.D 15.D 16.A 17.B(每小题3分,共27分)
三、1 8.(4分)B、D、F(错选不给分,少选1个给2分,少选2个给1分)
19.(14分)(1)稀盐酸 KSCN溶液 2Fe2++C12=2Fe3++2C1-
Fe3++SCN-=[Fe(SCN)]2+ (前二空格各1分,后二空格各2分)
(2)少量的Fe2+转化为Fe3+,加入KSCN后显淡红色4FeCl2+4HCl+O2=4FeCl3+2H2O
(每空2分)
(3)不合理我的猜想是[Fe(sCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在
褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
 (第l空1分,第2空3分)
(第l空1分,第2空3分)
四、20.(6分)(I)H2S(2)NO (3)3.6 (每空2分)
21.(8分)(1)如右图
(2)0.5mol/L
(3)H2和CO(或H2和CO2或H2O和CO)
(4)0.5mol/L (每空2分)
22..(7分)(1)氧,氯(每格1分)(2)极性分子(1分)
![]() (2分,未标电子转移方向和数目,扣1分。)
(4)
(2分,未标电子转移方向和数目,扣1分。)
(4)![]() (2分)
(2分)
23.(7分)(1)NaOH(1分)(2)①2Na2O2+2CO2=2Na2CO3+O2(2分)![]() (2分)③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等;(2分)
(2分)③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等;(2分)
24.(11分)(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O (2分)
(2)0.025 (2分)
(3)0.005 0.005 (每格2分)
(4)0.005<X<0.015 (3分)