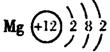高三化学第一次复习质量检测试题
化 学 试 题
考生注意:
1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间100分钟。
2.答卷前将密封线内的项目填写清楚。
第I卷(共105分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A或B)涂写在答题卡上。考试结束,将试题和答题卡一并交回。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试题卷上。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Zn:65
一、(本题包括16小题,每题3分,共48分,每小题只有一个选项符合题意)
1.SK-Ⅱ是一种非常有名的美容化妆品,在国家质检总局的质量检查中,查出SK-Ⅱ含有微量的铬。日常生活中大量使用的不锈钢也是含铬的铁合金,化合态的铬是重金属离子,对环境有严重的污染,化妆品中微量的铬也会对人体皮肤造成较大伤害。下列关于铁和铬的说法不正确的是 ( )
A.工业上可用铝热反应冶炼铬
B.铬和铁的最高价氧化物对应水化物显强碱性
C.铬和铁均为过渡元素,位于第四周期
D.含铬的工业废水不能直接排放
2.加成反应是有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应。下列过程与加成反应无关的是 ( )
A.苯与溴水混合振荡,水层颜色变浅
B.裂化汽油与溴水混合振荡,水层颜色变浅
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷
3.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H14O的物质。对于此过程,以下分析中不正确的是 ( )
A.C6H14O分子含有羟基
| |
C.实验小组分离出的酯可表示为CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量水解
4.下列基本实验操作或对实验事实的叙述中正确的是 ( )
A.硫黄保存在二硫化碳中,碱金属要保存在煤油中
B.为了实验安全,做氢气还原氧化铜实验是,先检验氢气纯度后再向试管中通气体
C.为了提高实验准确度,用量筒量取一定量硫酸时,倒出硫酸后再用蒸馏水洗涤量筒,并将洗涤液倒入所量取的溶液中
D.浓硫酸不小心沾在皮肤上,立即用布拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液
5.下列事实中,能说明氯元素原子得电子能力比硫元素原子强的是 ( )
①HCl的溶解度比H2S大 ②盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2S强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在元素周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-< S2-
A.③④⑤⑦⑧⑨ B.③⑥⑦⑧ C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨
6.两种短周期元素组成的化合物中,原子个数比为1:3。若两种元素的原子序数分别为a和b,则a和b的关系可能是 ( )
①a = b+5 ②a + b =8 ③a + b = 30 ④a = b+ 8
A.①②③④ B.②③④ C.只有②③ D.只有③④
7.14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法中不正确的是 ( )
①![]() mol14CH4分子中所含中子数为NA
mol14CH4分子中所含中子数为NA
②7g14C原子形成的石墨中所含质子数为3NA
③17g甲基(14CH3)所含电子数为8NA
④常温常压下,22.4L14CO2其分子数为NA
A.①② B.①③ C.①②③ D.③④
8.下列在指定溶液中的各组离子,能够大量共存的是 ( )
A.无色溶液中:HCO3-、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+) = 10-12mol·L-1的溶液中:Fe2+、SO42-、K+、SCN-
9.下列离子方程式中正确的是 ( )
A.硫酸铜溶液中通入硫化氢:Cu2+ + H2S = CuS↓+2H+
B.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3↑+ H2O
C.氧化铁可溶于氢碘酸:Fe2O3 + 6H+ = 2Fe3+ + 3H2O
|
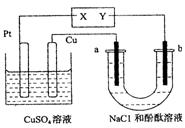
10.如图所示a、b都是惰性电极,通电一段时间后,
b极附近溶液显红色。下列说法中正确的是( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH逐渐增大
D.CuSO4溶液的pH保持不变
11.下列说法正确的是 ( )
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度和乘积是一个常数
B.AgCl的Ksp=1.8×1010mol2·L-2,在任何含AgCl固体的溶液中,c (Ag+) = c(Cl-),且Ag+和Cl-浓度的乘积等于1.8×10-10mol2·L-2
C.温度一定时,AgCl饱和溶液中,Ag+和Cl-浓度和乘积是一个常数
D.向饱和AgCl溶液中加入盐酸,Ksp值变大
12.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 ( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
13.将a mol醋酸钠和b mol硝酸溶于水配成1L溶液,且2b > a > b,以下关于溶液中分子、离子浓度的关系正确的是 ( )
A.c (CH3COO-) = (a-b) mol·L-1
B.c (CH3COO-) = b mol·L-1
C.c (CH3COO-) + c (CH3COOH) = a mol·L-1
D.c (Na+) > c (NO3-) > c (CH3COOH) > c (OH-) > c (H+)
14.已知0.1 mol·L-1的Na2CO3溶液的pH = 10,同浓度的Na [Al (OH)4]的溶液的pH = 11。将同浓度的NaHCO3和Na [Al (OH)4]两种溶液等体积混合,可能较大量生成的物质是( )
|
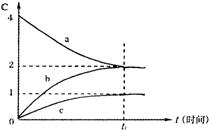
15.800℃时,a、b、c三种气态物质的浓度随着时间
的变化情况如下图所示。由图分析不能得出的结
论是 ( )
| |
B.t1后,若升高温度,正反应速率增大
C.t2后,若升高温度,a的转化率增大
D.t1后,若增大压强,混合气体的平均相对分子
质量增大
16.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3等五种溶液中的一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是 ( )
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
第Ⅱ卷(非选择题,共52分)
二、(本题共16分)
![]() 17.(Ⅰ)(7分)德国人哈伯在1905年发明的合成氨反应原理为:N2(g) + 3H2(g) 2NH3(g);已知298K时:△H =-92.4kJ·mol-1,△S =-198.2J·mol-1·K-1,试回答下列问题:
17.(Ⅰ)(7分)德国人哈伯在1905年发明的合成氨反应原理为:N2(g) + 3H2(g) 2NH3(g);已知298K时:△H =-92.4kJ·mol-1,△S =-198.2J·mol-1·K-1,试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298K下合成氨反应能自发进行(列出算式即可) 。
其浓度商(Qc) 化学平衡常数(Kc)(填大于、等于、小于)时,反应向右进行。
(2)在实际工业合成氨生产中采取的措施是 (填序号)
A.采用较低压强
B.采用700K左右的高温
C.用铁触媒作催化剂
|
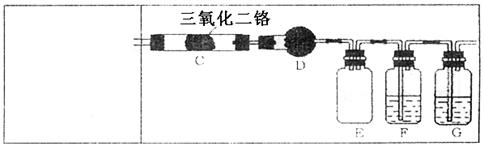
和H2
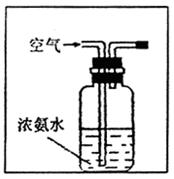
(3)右图是实验室模拟工业法合成氨的
简易装置,简述检验有氨气生成的
方法 。
|
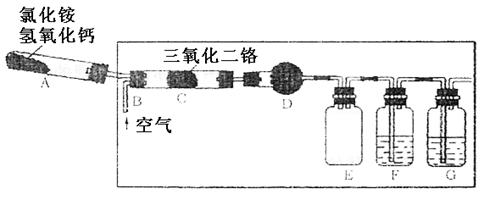
回答下列问题:
(1)实验时,A、C两装置均需加热,应先加热 装置,原因是
;
(2)D装置中应填充的物质是 ,该物质的主要作用是
;
(3)E装置的作用是 ,F、G装置中的物质分别是
;
|
三、(本题包括2小题,共18分)
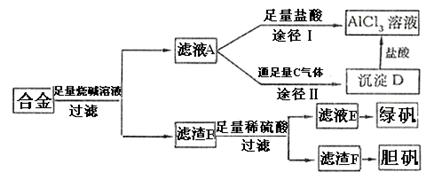
18.(13分)某化学小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案
|
试回答下列问题:
(1)过滤用的玻璃仪器有 。
(2)写出滤液A转化为沉淀D的离子方程式 。
(3)由滤液A制AlCl3溶液的途径有Ⅰ和Ⅱ两条,你认为合理的是途径 (填“Ⅰ”和“Ⅱ”),理由是 。
(4)从滤液E中得到绿矾晶体的实验操作是 、 、 。
(5)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式是 。
(6)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理? ;理由是
。
19.(5分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。D、A按原子个数比3:2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是 ,D元素的原子结构示意图是
。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是
(用元素符号填写)。
(3)乙加入到水中发生反应的离子方程式是
四、(本题共10分)
20.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
|
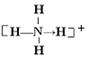
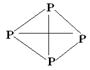
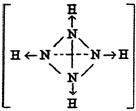
(3)已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
|
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 ,
请画出N4H44+的结构式 ;
![]() (4)已知液氨中存在着平衡2NH3 NH4+NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式 。
(4)已知液氨中存在着平衡2NH3 NH4+NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式 。
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”,以此溶液中加入少量的强碱和强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O + H+ = NH4+ +H2O
加碱时:NH4+ +OH- = NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c (H+)与c (OH-)基本保持不变;
含有一定量的NaH2PO4和NaHPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时 ;
加碱时 。
|
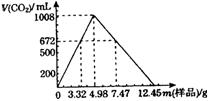
21.(8分)自然界存在的某天然碱(纯净物)的组成
表示 为aNa2CO3·bNaHCO3·cH2O(a、b、c
为正整数)。现称取不同质量的天然碱样品,溶于
水后,分别逐滴加入相同浓度的盐酸30.0mL,产
生二氧化碳的体积(标准状况)如图所示。
(1)若用2.49g样品进行同样的实验时,产生二氧化碳 mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时碳酸钠不分解),产生
112mL二氧化碳(标准状况)和0.450g水,试通过计算确定该天然碱的化学式
。
(3)实验所用盐酸的物质的量浓度为 。
(4)若在上述某次实验中,收集到336mLCO2(标准状况)气体,该次实验中称取天然碱样品的质量可能是 。
参考答案
一、(每题3分,本题共48分)
1.B 2.A 3.D 4.D 5.C 6.B 7.A 8.B 9.A
10.A 11.C 12.A 13.C 14.B 15.C 16.B
二、(本题共16分)
17.(16分)(Ⅰ)(7分)
(1)△H-T△S=-92.4KJ·mol-1-298K×(-198.2×10-3)KJ·mol-1·k-1< 0,(1分)
Q<K(1分)
(2)BCD(3分)
(3)用湿润的红石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成(2分)
(Ⅱ)(9分)
(1)C(1分)使催化剂达到适宜温度,提高NH3的转化率(1分)
(2)P2O5或无水CaCl2(1分)除去C中未反应的氨气(1分)
(3)安全瓶,防止倒吸(1分) 水(1分) NaOH溶液(1分)
|
(4) (2分)
三、(本题共18分)
18.(3分)(1)烧杯、漏斗、玻璃棒(1分,全对给分)
(2)[Al (OH)4]- + CO2 = Al (OH)3↓+ HCO3-(2分,写CO32-或化学方程式不给分)
(3)途径Ⅱ(1分)
因为滤液A是Na[Al(OH)4]和NaOH溶液,按途径Ⅰ直接向A中加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入CO2气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的纯净的AlCl3溶液。所以途径Ⅱ更合理。(2分)
(4)蒸发浓缩、冷却结晶、过滤(2分)
(5)Cu + H2O2 + H2SO4 + 3H2O = CuSO4·5H2O或Cu+H2O2 + H2SO4 = CuSO4 + 2H2O
(2分)
(6)不合理(1分)因为该方案操作步骤多、时间长,消耗试剂量更大。(2分)
|
(1)第2周期,VIA族(1分) (1分)
(2)O < N < Al < Mg < Na (1分)
(3)2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ (2分)
四、(本题共10分)
20.(10分)
|
(3) (2分)
(4)8NH3 + 4CsOH = N4 + 4CsNH2 + 6H2 + 4H2O (2分)
(5)HPO42- + H+ = H2PO4- (2分)
H2PO4- + OH- = HPO42- + H2O (2分)
五、(本题共8分)
21.(8分)(1)504 (2)2Na2CO3·NaHOC3·2H2O
(3)2.50mol·L-1 (4)1.66g或9.96g(每空2分)