高三化学模拟试题
班级 姓名 号次
一、选择题
1.冰的晶体中,分子间存在的最强作用力是 ( )
A.离子键 B.共价键 C.氢键 D.范德瓦耳斯力
2.下列说法不正确的是 ( )
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B. 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101KPa时 , 1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
3.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 ( )
A.将含有NO2和N2O4分子共约6.02×1023个的混合气,温度降至标准状况,其体积约为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数约为6.02×1022个
C.0.05molC5H12分子中所含共价键数约为6.02×1023
D.标准状况下,1molSiO2晶体中含有共价键数约为2×6.02×1023
4.下列离子方程式表示正确的是 ( )
A.铜片加入稀硝酸中: Cu + NO3—+ 4 H+![]() Cu2+ + NO↑+ 2 H2O
Cu2+ + NO↑+ 2 H2O
B.过量SO2通入次氯酸钙溶液中:Ca2+ + 2ClO- + SO2 + H2O![]() CaSO3↓+ 2HClO
CaSO3↓+ 2HClO
C.等体积、等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3—
+ Ba2+ + OH—![]() BaCO3↓+ H2O
BaCO3↓+ H2O
D.铁作电极电解饱和食盐水:2Cl-+ 2H2O![]() 2OH-+ H2 ↑+ Cl2↑
2OH-+ H2 ↑+ Cl2↑
![]() 5.一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g),若N2,H2、NH3起始浓度分别为c(N2)、c(H2)、c(NH3)
(均不为0),平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
( )
5.一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g),若N2,H2、NH3起始浓度分别为c(N2)、c(H2)、c(NH3)
(均不为0),平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
( )
A、起始时N2利H2的浓度之比为c(N2):c(H2)=l∶3
B、平衡时H2和NH3的生成速率之比为3∶2
C、N2和H2的转化率之比为1∶3
D、达到平衡后,若保持温度不变,将容器的体积增大一倍,平衡向逆反应方向移动
6.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A、6g B、8g C、10g D、12g
7.pH=1的两种一元酸HX和HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为v(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是
A、HX可能是强酸
B、HX的酸性比HY的酸性弱
C、两酸的浓度大小c(HX)<c(HY)
D、pH=l的两种一元酸均稀释100倍,稀释后两溶液的pH均为3
8.下表为元素周期表短周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A、常压下五种元素的单质中w单质的沸点最高
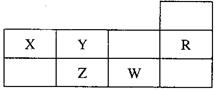 B、z的氢化物的沸点比Y的氢化物的沸点高
B、z的氢化物的沸点比Y的氢化物的沸点高
C、w元素最高价氧化物的水化物酸性比z元素的强
D、w、Y的阴离子电子层结构与R原子的相同
9.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
10.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
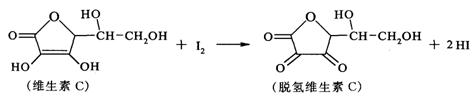
下列说法正确的是 ( )
A.上述反应为取代反应
B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂
D.维生素C的分子式为C6H8O6
二、填空题
11.如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去)
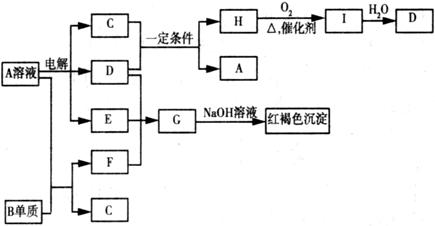
请回答下列问题:
(1)写出A的化学式: ; G的化学式: ;
(2) B元素在元素周期表中的位置为: ;
(3)写出电解A溶液的离子方程式: ;
(4) 若向F的溶液中加入足量的NaOH溶液,可观察到的现象 ;
(5)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的负极材料可以是: ;正极的电极反应是 。
12.在一刚性密闭容器中发生化学反应2A![]() B+D,在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D,在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据以上数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(A)为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且c3 1.0mol/L(填>、=、<=。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”或“放热”)。理由是 。
13.现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官
能团不直接与苯环相连,C的结构简式是________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有
两种,D的结构简式是__________________________。
14.(1)在FeSO4溶液中滴入2滴KSCN溶液,然后再加入浓硝酸,溶液变成血红色。反应的离子方程式为:①____________________________________________,②Fe3++xSCN-![]() [Fe(SCN)x](3-x)+,但过一会,溶液的血红色快速褪去,有红棕色气体放出,(已知Fe2+与HNO3反应是快反应),则产生红棕色气体的原因可能是______离子与HNO3作用的结果。
[Fe(SCN)x](3-x)+,但过一会,溶液的血红色快速褪去,有红棕色气体放出,(已知Fe2+与HNO3反应是快反应),则产生红棕色气体的原因可能是______离子与HNO3作用的结果。
(2)为探究反应原理,取少量浓硝酸于试管中,然后加入KSCN溶液,振荡后滴入BaCl2溶液,设计此实验的目的是______________________________。将产生的气体通入足量的NaOH和Ca(OH)2的混合溶液中,此步骤操作是为了________________________________。
(3)向盛有有[Fe(SCN)x](3-x)+溶液的3支试管中分别滴入①氯水②溴水③碘水,设计此实验的目的是________________________________________________。用KSCN溶液间接检验Fe2+时,氯水、HNO3为什么不能加过量_______________________________。
1 5. “套管实验”具有装置简洁便利等有优点,结合图示回答有关问题。
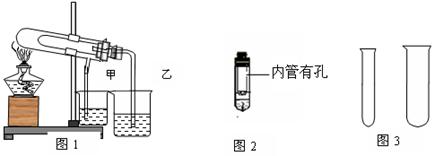
(1)欲利用图1比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物。最好应在大试管
底部加入 (填化学式),石灰水变浑浊的烧杯有______(填:甲、乙)
(2)欲利用图2验证铜与浓硝酸的反应产物,该装置除简洁外,还有一个明显的优点是:
。
(3)用锌粒和稀硫酸用图3制取氢气,并收集一试管,锌粒和稀硫酸应放在 试管中
(填:大、小)组成发生装置,理由是: 。该反应的离子方程式为
14. (1) A CuSO4; G Fe2(SO4)3;(各2分)
(2) 四、Ⅷ;(2分)
(3) ![]()
(4)先有白色沉淀生成,然后白色沉淀迅速变成灰绿色再变成红褐色;(2分)
(5) 铁;(2分) Cu2+ + 2e- = Cu(2分)

1.(8分)
(1)Na2CO3 (1分) 乙 (1分)
(2)有毒气体不会排放到空气中(2分)
(3)小试管(1分) 大试管倒套有利用于空气排出(1分)Zn +2H+ = Zn2+ + H2↑(2分)
(4)①b ②![]()
③先撤出导管,以免发生倒吸.
26.(本题每空2分,共14分)
(1)0.013
(2)1.0 催化剂
(3)> >
(4)吸热 温度升高时平衡向正反应方向移动
23.⑴ 6.67% ⑵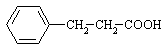 ⑶
⑶![]()
⑷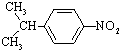
27、(12分,每空2分)
(1)2Fe2++Cl2=2Fe3++2Cl- ;[Fe(SCN)x](3-x)+或SCN-
(2)检验KSCN被氧化后得产物有无SO42-
吸收NO2等有害气体并检验CO2
(3)检验SCN-(或[Fe(SCN)x](3-x)+)还原能力的强弱;防止SCN-(或[Fe(SCN)x](3-x)+)被氧化