高三化学模拟试题
班级 姓名 号次
一、选择题
1.为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法可以提高燃料的燃烧效率的是 ( )
A.将煤转化成煤气或转化为甲醇等液体燃料来燃烧 B.将煤脱硫后燃烧
C.通入大大过量的空气 D.将煤干馏成煤焦油来燃烧
2.已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-。若在某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是 ( )
A. Br- B. Cl- C. OH- D. S2-
3.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是 ( )
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Na+、AlO2-、NO3-
C.K+、Ca2+、MnO4-、Cl- D.NH4+、Fe3+、SO42-、SCN-
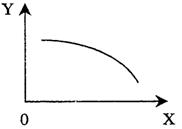
4. 右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl C.PH3 D.SiH4
5.下列有关化学实验的操作或说法中,正确的是 ( )
A.配制氯化铁溶液时,先将氯化铁溶于浓盐酸,再用蒸馏水稀释并加入适量铁粉
B.用加热法测定硫酸铜晶体中结晶水含量时,若在空气中冷却会使结果偏低
C.将浓硫酸在量筒中稀释
D.将锌粒投入CuSO4溶液中充分反应后,固体质量一定增加
6.草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是 ( )
A.c (K+) + c (H+) = c (HC2O4-) + c (OH-) + c (C2O42-)
B.c (C2O42-) > c (H2C2O4)
C.c (HC2O4-) + c (C2O42-) = 0.1mol·L-1
D.c (K+) = c (H2C2O4) + c (HC2O4-) + 2c (C2O42-)
7.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是 ( )
A.两种气体的压强相等 B.O2比O3的质量小
A.两种气体的分子数目相等 D.两种气体的氧原子数目相等
8.下列描述中,不符合生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
9.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+![]() O2(g)=CO(g);△H=-393.5 kJ/mol
O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
10.
|
![]() 2NO2(g) 2NO(g)+O2(g);△H>0,
2NO2(g) 2NO(g)+O2(g);△H>0,
达到平衡。当改变其中一个条件X,Y随X
的变化符合图中曲线的是 ( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示NO2的物质的量
二、填空题
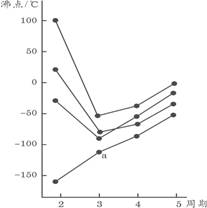
11.如图所示的是以黄铁矿为主要原料接触法制硫酸工业流程示意图。回答下列问题:
(1)从出口⑥处排出的气体一般不应含有 (填序号)
A.SO3 B.N2 C.SO2 D.水蒸气
(2)对从进口⑧喷进的液体的叙述最准确的是 (填序号)
A.水 B.发烟硫酸 C.98.3%的浓硫酸 D.稀硫酸
(3)设备A中发生反应的化学方程式为
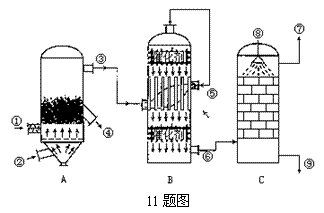
12.盐W的饱和溶液在电解时的产物能发生如下图所示的系列变化。图中每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已经略去)。已知:A、B、C、D、E在常温常压下均是气态物质,A的水溶液pH大于7,W的饱和溶液pH小于7,反应①属于置换反应。
回答下列问题:
(1)A的电子式为
(2)反应②的化学方程式
(3)反应③的离子方程式 。
13.化合物A(C4H10O)可以发生以下变化:
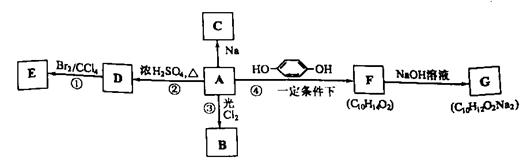
根据上述变化,回答下列问题:
(1)A分子中的官能团名称是 。
(2)A光照下只有一种氯取代物B,则A的结构简式为 ,
B的结构简式为 。
(3)反应①、②、③的反应类型分别为 、 、 。
(4)写出反应④的化学方程式(有机物写结构简式)
。
 14.久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:
14.久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:![]()
![]() n
n![]() 热量.
热量.
试回答下列问题:(1)分离混合物得到(C2H4O)n,基本方法是: 。
(2)设计一个简单实验证明久置的乙醛是否被氧化(写出简要操作步骤、使用的试剂、实验现象和结论):_______________________________________________________.
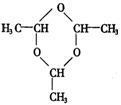
(3)当n=3时,试写出(C2H4O)n的结构简式___________________________.
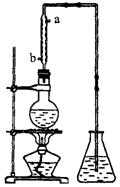
(4)提取乙醛的装置如图,烧瓶中的液体是(C2H4O)n和6mol/L H2SO4的混合物,锥形瓶中盛放蒸馏水,加热混合物至沸腾,(C2H4O)n缓缓分解,生成的气体导入锥形瓶中.
①冷凝管中冷凝水的进口是________(填“a”或“b”).
②若实验过程中不使用冷凝管冷却,随着蒸发的进行,溶液中有黑色物质和刺激性气味气体生成.请用化学方程式表示这一现象:________________________________________。
③当锥形瓶内导管口气泡越来越少时,表明乙醛基本部分蒸出,实验结束.拆除实验装置的第一步操作是:__________________________________________________________。
(1),将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出。
(2)取少量下层水溶液,滴加石蕊指示剂,若溶液显红色,则说明部分乙醛被氧化,(其他合理答案均得分)
(3)
22.(每空2分,共6分)
(1)NH3的电子式
(2)Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(3)Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+