高三化学模拟试题
班级 姓名 号次
一、选择题
1.2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是( )
 A.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
A.蛋白质均为天然有机高分子化合物,没有蛋白质就没有生命
B.蛋白质均易溶于水,均能跟浓硝酸作用变黄
C.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
D.可以采用多次盐析或多次渗析的方法分离提纯蛋白质
2.下列变化或数据与氢键无关的是 ( )
A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B.氨分子与水分子形成一水合氨
C.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
D.SbH3的沸点比PH3高
3.下列反应离子方程式正确的是 ( )
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH— == AlO2— + 2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O— →2C6H5OH + CO32—
C.向小苏打溶液中加入醋酸溶液:HCO3— + H+ == CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 == Fe3+ + Br2 + 4Cl—
4.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2 + 6FeI2 == 2FeCl3 + 4FeI3 B.Cl2 + 2Fe2+ == 2Fe3++ 2Cl—
C.Co2O3 + 6HCl == 2CoCl3 + 3H2O D.2Fe3+ + 2I— == 2Fe2+ + I2
 5. 已知在101kPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-820kJ/mol。下列说法中正确的是( )
5. 已知在101kPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-820kJ/mol。下列说法中正确的是( )
A、反应过程中能量关系可用右图表示
B、CH4的燃烧热是820kJ
C、11.2LCH4完全燃烧放出热量410kJ
D、若将此反应设计成原电池,甲烷在正极被氧化
6.两份等体积、等浓度的NaOH溶液,分别与体积相等的MgCl2、AlCl3溶液混合,充分反应后,Mg2+、Al3+均恰好形成沉淀,则原MgCl2、AlCl3溶液中Cl-浓度之比为 ( )
A.1∶1 B.1∶2 C.2∶3 D.3∶2
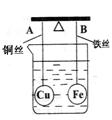
7.
|
一段时间后,下列有关杠杆的偏向判断正确的是(实验
过程中不考虑铁丝反应及两边浮力的变化) ( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端低B端高
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
8.在下列实验中,不能达到目的的是 ( )
A.用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢的活泼性强弱
B.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D.为确定溴乙烷中含有溴元素,向该溴乙烷中加入NaOH水溶液后,再加入AgNO3
溶液
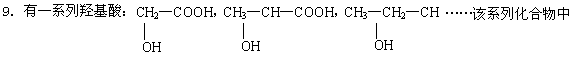 碳元素的质量分数的最大值是 ( )
碳元素的质量分数的最大值是 ( )
A.32% B.46.6% C.85.7% D.无法确定
10.在恒温恒容的密闭容器中,发生反应3A(g)+B(g) ![]() xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是 ( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
二、填空题
11.已知a、E、b为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | E | b |
| 原子核数 | 单核 | 三核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、b构成,B、C都是单质,反应①、②都是用于工业生产的反应,各
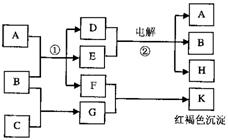 有关物质之间的相互反应转化关系如下图所示,部分生成物已略去。请填写下列空白:
有关物质之间的相互反应转化关系如下图所示,部分生成物已略去。请填写下列空白:
(1) 写出b粒子的电子式_______________
C在元素周期表中的位置_____________
(2)写出反应①的离子方程式____________
写出反应②的化学方程式______
(3) 实验室配制G溶液时需要加入一定量______,
理由是
(用相关文字和离子方程式表示)。
12.有甲、乙两份等体积的浓度均为![]() 的氨水,pH=11。
的氨水,pH=11。
①将甲用蒸馏水稀释100倍,则![]() 的电离平衡向__________(填“促进”或“抑制”)电离的方向移动,溶液的pH将变为____________(填序号)
的电离平衡向__________(填“促进”或“抑制”)电离的方向移动,溶液的pH将变为____________(填序号)
A. 9~10之间 B. 11
C. 12~13之间 D. 13
②将乙用![]() 的
的![]() 溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,甲的pH__________(填“大于”、“小于”或“等于”)乙,其原因是
溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,甲的pH__________(填“大于”、“小于”或“等于”)乙,其原因是
_____________________________________________________________________。
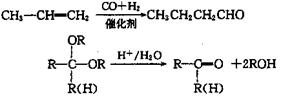
13.化合物A是石油化工的一种重要的原料,用A和水煤气为原料烃下列途径合成化合物D(分子式为C3H6O3)
|
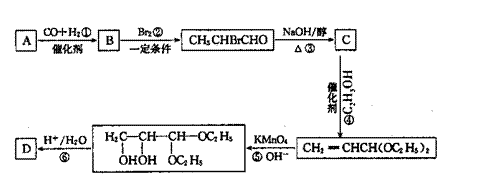 |
(2)
(1)写出下列物质的结构简式: A. D.
(2)指出反应②反应类型
(3)写出反应③的化学方程式 。
(4)反应④的目的是 。
(5)化合物G是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的
中间产物。G在浓硫酸存在的条件下加热,既可生成能使溴水褪色的化合物E(C3H4O2),
又可生成六原环状化合物F(C5H3O4),请分别写出G生成E和F的化学方程式:
G→E:
G→F:
14.实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
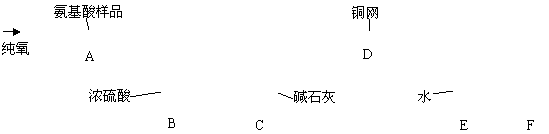
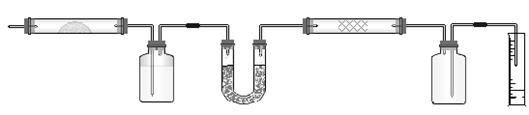
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是________________________。
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是________________________________ _____。
(4)装置D的作用是________________________________________________ _____。
(5)读取N2的体积时,应注意①__________ __;②________ ___。
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是________________________。