高三化学模拟试题
班级 姓名 号次
一、选择题
1.下列物质中,长期露置于空气中会发生颜色变化的是 ( )
①绿矾 ②氢氧化亚铁 ③氯水 ④苯酚 ⑤亚硫酸钠 ⑥过氧化钠
A.全部 B.①②③④⑥ C.只有①②③ D.只有②③④
2.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A.SiO2和SO2 B.NaOH和H2O2
C.CO2和H2O D.NaCl和HCl
3.能正确表示下列化学反应的离子方程式是 ( )
A.氯气通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
B.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
C.硫酸铝溶液中加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
![]() D碳酸氢铵溶液中加入过量的氢氧化钠溶液:NH4++OH-
NH3·H2O
D碳酸氢铵溶液中加入过量的氢氧化钠溶液:NH4++OH-
NH3·H2O
4.设某氨水pH值为x,某稀盐酸的pH值为y,且x+y=14,x>11。如果将上述两溶液分别取出10mL充分混合后,所得溶液中各种离子浓度由大到小的顺序是 ( )
A.c (Cl-)>c (NH4+)>c (OH-)>c (H+) B.c (NH4+)>c (Cl-)>c (OH-)>c (H+)
C.c (NH4+)>c (Cl-)>c (H+)>c (OH-) D.c (Cl-)>c (NH4+)>c (H+)>c (OH-)
5.下列指定的微粒数目,大小顺序排列正确的是 ( )
①1 mol苯分子中所含原子数;②6.02×1023个H2O所含电子数;③标准状况下,2.24 L氧气中所含氧分子数;④12克12C里所含中子数
A.①>②>③>④ B.①>②>④>③
C.④>③>①>② D.④>③>②>①
6.某无色溶液中,离子能大量共存的离子组是 ( )
A.Na+、Cu2+、OH-、Cl- B.H+、Na+、Fe2+、NO3-
C.K+、 Fe3+、Cl-、S2- D.Na+、 K+、Ba2+、OH-
7. 设NA为阿佛加德罗常数,其近似值为6.02×1023,下列说法不正确的是 ( )
A.6.4g铜与足量的硫黄在绝隔空气的条件下反应,则此反应中电子转移的数目为0.1×6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子数为2×6.02×1023
C.0.![]() 原子中含中子数为3.6×6.02×1023
原子中含中子数为3.6×6.02×1023
D.30 g甲醛中含共用电子对数为4×6.02×1023
8.用铂作电极电解某种溶液,通电一段时间,溶液的PH变小,并且在阳极上得0.56L气体,阴极上得到1.121L气体(两种气体均在相同条件下测定)。由此可知该溶液可能是
( )
A.稀盐酸 B.KNO3溶液 C.CuSO4溶液 D.稀硫酸
9.在25°C、101 kPa下,a g甲醇燃烧生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则甲醇燃烧的热化学方程式正确的是 ( )
![]()
![]()
![]() A.
A. ![]()
![]() (g)
(g) ![]() (g)+2H
(g)+2H![]() O(l) ΔH=+b
kJ/mol
O(l) ΔH=+b
kJ/mol
![]()
![]() B.
B. ![]()
![]() (g)
(g) ![]() (g)+2H
(g)+2H![]() O(l) ΔH=-b
kJ/mol
O(l) ΔH=-b
kJ/mol
![]()
![]() C.2CH
C.2CH![]() OH(l)+3O
OH(l)+3O![]() (g) 2CO
(g) 2CO![]() (g)+4
(g)+4![]() (l) ΔH=-b
kJ/mol
(l) ΔH=-b
kJ/mol
![]()
![]() D.2
D.2![]() OH(l)+3
OH(l)+3![]() (g) 2CO
(g) 2CO![]() (g)+4
(g)+4![]() (l) ΔH=+2b
kJ/mol
(l) ΔH=+2b
kJ/mol
10.用pH均为1的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸的溶液 的体积分别为V1和V2,则V1和V2的关系正确的是 ( )
A. V1> V2 B. V1< V2 C. V1= V2 B. V1≤V2
11.下列叙述正确的是 ( )
A.附着银的试管可先用少量稀氨水溶解,再用水洗净
B.苯酚的浓溶液不慎沾到皮肤上,应立即用氢氧化钠溶液擦洗
C.应将浓硝酸盛放在带橡胶塞的试剂瓶中,且置于冷暗处保存
D.除去乙酸乙酯中的乙酸可加入饱和碳酸钠溶液,然后分
12.一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、 c2、c3(均不为零),平衡时X、Y、Z的浓度分别为0.1mol·L
2Z(g),若X、Y、Z起始浓度分别为c1、 c2、c3(均不为零),平衡时X、Y、Z的浓度分别为0.1mol·L![]() 、0.3mol·L
、0.3mol·L![]() 、0.08mol·L
、0.08mol·L![]() ,则下列判断错误的是
( )
,则下列判断错误的是
( )
A.c1∶c2=1∶3
B.平衡时,Y和Z的生成速率之比3∶2
C.X、Y的转化率不相等
D.c1的取值范围是0<c1<0.14 mol·L-1
二、填空题
13. 在给定条件下,下列物质间可发生如下图所示的转化,有的反应的部分产物未写出。其中,B、C是常见气体,C能使澄清石灰水变浑浊,F常温下为无色液体,H是淡黄色固体。请按要求回答下列问题。
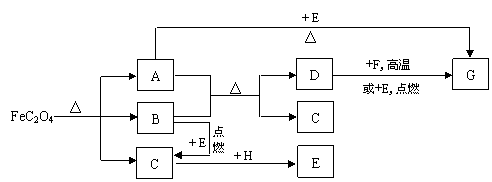 |
(1)写出A、C的化学式 。
(2)7.8g H与足量C反应可生成E L(标准状况)。
(3)实验室检验物质E的方法是 。
(4)H和F反应的离子方程式为 。
(5)写出D与F发生反应的化学方程式 。
14.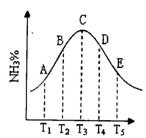 在容积相同的不同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2
在容积相同的不同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2![]() 2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
(1)A、B、C、D、E五点中,尚未达到化学平衡的点是__________;
(2)该可逆反应的正反应是_______(填“吸热”或“放热”)反应。
(3)由T1 向T2变化时,v正_______v逆(填>、<或=,下同);由T3向T4变化时,v正_______v逆。
(4)已知E点对应的纵坐标为20%,问E点混合气体的平均相对分子质量是_________.
15.有机物A的结构简式如下图所示:
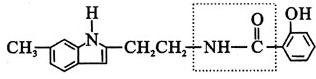
(1)A的分子式为______________
(2)在一定条件下,lmolA最多能与________mo1H![]() 发生加成反应
发生加成反应
(3)在A的结构简式中,虚线框内的结构名称为_____________
(4)有机物A在稀硫酸中受热会水解成B和C,其中C具有酸性,则有机物C的结构简式为_________________
(5) 有机物C和下列哪种物质反应可以得到分子式为![]() 的盐?__________
的盐?__________
A.NaOH B.Na![]() SO
SO![]() C.NaHCO
C.NaHCO![]() D.Na
D.Na![]() CO
CO![]()
(6) 有机物C的同分异构体中属于酚类,同时又属于酯类的化合物有_________种;若
有机物C的同分异构体中属于酚类,但不属于酯类,也不属于羧酸类的化合物必定含有的官能团(除羟基外)是________________
16.为了测定空气中CO2的含量,可按如下步骤进行实验:
①分别配制100mL0.1mol·L-1和100mL0.01mol·L-1的标准盐酸;
②用0.1mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10mL,用去标准盐酸19.6mL;
③另取上述Ba(OH)2溶液10mL放入100mL的容量瓶中,加蒸馏水稀释至刻度,把稀释后溶液放入密闭容器中并导入10L(标准状况下)空气,充分振荡后过滤;
④取上述滤液20mL,用0.01mol·L-1的盐酸滴定,用去盐酸34.8mL。
根据上述实验回答下列问题:
(1)配制上述标准盐酸时,所需的玻璃仪器有:移液管(用于准确量取所需较浓盐酸的体积)、烧杯、 ;
(2)写出第③步的密闭容器中所发生反应的离子方程式:
;
(3)滴定过程中左手绝对不能离开活塞,右手拿住锥形瓶瓶颈并 ;眼睛应始终注视 ,
(4)若第②步滴定时使用过的酸式滴定管未经处理,立即更换溶液进行第④步滴定,会使实验结果 (填“偏高”、“偏低”或“无影响”);
(5)根据实验数据可以计算出空气中CO2的体积百分含量是 。