专题五 原子 分子 晶体结构
【考点分析】
1.了解元素、原子、分子、离子等概念的涵义
2.了解原子组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
3.以第1、2、3周期的元素为例,了解原子核外电子排布规律。
4.理解离子键、共价键的含义;理解极性键和非极性键;了解极性分子和非极性分子;了解分子间作用力;初步了解氢键。
5.了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
6.以上知识在高考命题中每年都有不同程度的体现。
【典型例题】
【例1】科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素
中最重的原子。关于该新元素的下列叙述正确的是
A.其原子核内中子数和质子数都是112
B. 其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D. 其原子质量与12C原子质量之比为277:12
【备选】同温同压下,等体积的两个密闭容器中分别充满12C18O和14N2两种气体,下列说法正确的是
A.质子数相等,质量不等 B.分子数和质量分别不等
C.分子数和质量都相等 D.原子数、中子数和质子数都相等
【备选】已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是
A. ![]() B.
B.
![]()
C. (A-n+2)mol D.
![]()
【例2】(2003全国高考)下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
【备选】已知C3N4晶体很可能具有比金刚石还大的硬度,且原子间均以单键结合。下列有关说法正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体的沸点可能在1000C以下
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
【例3】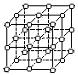 右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl—离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有
个。(12个)
右图中直线交点处的圆圈为NaCl晶体中Na+离子和Cl—离子所处的位置。请将其中代表Na+离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na+离子周围与它最接近的且距离相等的Na+离子共有
个。(12个)
【备选】第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4或1个游离水分子。根据以上信息,完成下面两题
(1)下列关于天然气水合物中两种分子极性的描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.CH4是极性分子 D.水是极性分子,CH4是非极性分子
(2)若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离水分子填充,则天然水合物的平均组成可表示为
A.CH4·14H2O B. CH4·8 H2O
C. CH4·23/3H2O D.CH4·8 H2O
【方法归纳】
1.方法与技巧
(1)原子结构
构成原子和离子的各基本粒子之间的数量关系和原子的和外电子排布知识,是解决有关原子结构问题的基础,复习时应注意理解。
(2)分子结构
①简单分子结构的确定
简单分子的结构可根据最外层电子数和各种原子形成相对稳定的结构时所需形成的共用电子对数确定,也可结合分子中各元素的化合价加以确定。
②键的极性与分子极性
分子的极性由键的极性和分子的空间结构共同决定。对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则该分子为非极性分子。
③分子中各原子是否满足8电子稳定结构的判断
一般地,在ABn型分子中,若“原子的最外层电子数+化合价的绝对值=8”,则分子中该原子最外层满足8电子稳定结构。
(3)晶体结构
掌握几种典型晶体(如氯化钠、氯化铯、金刚石、二氧化硅、干冰、石墨等)的空间结构特征,构成晶体的基本粒子及其相互间的作用力,每种晶体的主要物理性质。通过这些具体物质的“化学事实”解决其他类似晶体结构问题。
2.解题注意点
(1)原子的相对原子质量与元素的相对原子质量不同,后者该元素的各种同位素的相对原子质量的加权平均值。
(2)共价化合物中一定没有离子键,离子化合物中可能含有共价键。
(3)对不熟悉物质的晶体类型的判断,要根据物质的性质加以判断。
3.命题趋向
原子结构和同位素的考点,常以重大科技成果为题材,寓较于考;化学键类型与晶体类型的判断、成键原子最外层8电子结构的判断、离子化合物和共价化合物的电子式、各类晶体物理性质的比较、晶体的空间结构等是高考的重点内容。
【专题训练A】
1.(2003上海高考题)13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtǔWthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
2.(2004天津理综)核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有原子数或中了数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象:
A.18O 31P 119Sn
B.27Al 19F 12C
C.元素周期表中VA族所有元素的原子
D.元素周期表中第一周期所有元素的原子
3.(2004上海)有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
4.(2003江苏高考)下列各分子中所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
5.(05广东)Se是人体必需微量 元素,下列有关![]() Se和
Se和![]() Se的说法正确的是
Se的说法正确的是
A、![]() Se 和
Se 和![]() Se互为同素异形体
B、
Se互为同素异形体
B、![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
C、![]() Se和
Se和 ![]() Se 分别含有44和46个质子 D、
Se 分别含有44和46个质子 D、![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
6.(05天津)下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
7.(05广东)下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是
A、NH4ClNH3↑+ HCl↑
B、NH3+CO2+H2O=NH4HCO3
C、2NaOH+Cl2=NaCl+NaClO+H2O
D、2Na2O2+2 CO2=2Na2 CO3+O2
8.(05上海)下列说法错误的是
A、原子晶体中只存在非极性共价键
B、分子晶体的状态变化,只需克服分子间作用力
C、金属晶体通常具有导电、导热和良好的延展性
D、离子晶体在熔化状态下能导电
9.(05上海)下列离子中,电子数大于质子数且质子数大于中子数的是
A、D3O+ B、Li+ C、OD¯ D、OH¯
10.(2004江苏)1919年,Langmuir提出等电子原理:原子数相同,电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
⑴根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
⑵此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子 、 。
(1)N2 CO; CO2 N2O (2)SO2、 O3
11.(05江苏)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
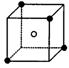
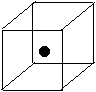 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
该反应的反应热△H = kJ/mol.
⑴ > < ⑵ 如下图 ⑶ +236
【专题训练B】
1.居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个![]() 原子中含有138个中子
原子中含有138个中子
B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高
D.Ra(OH)2是一种两性氢氧化物
2. 下列关于只含非金属元素的化合物的说法中,正确的是
A. 有可能是离子化合物 B. 一定是共价化合物
C. 其晶体不可能是原子晶体 D. 其晶体不可能是离子晶体
3.关于晶体的下列说法中正确的是
A.只要是离子晶体就一定含有金属阳离子和酸根阴离子
B.原子晶体的熔点肯定高于其他任何一种晶体
C.分子晶体的熔点不一定比金属晶体的熔点低
D.离子晶体中肯定不含有非极性共价键
4.x、y均为短周期元素,且x为ⅠA族元素,y为ⅥA族元素。下列说法正确的是
A.x的原子半径一定大于y的原子半径
B.由x、y形成的共价化合物中所有原子都满足最外层为8电子结构
C.x2y既可能是离子化合物,也可能是共价化合物
D.由x、y组成的化合物中,x、y的原子个数比不可能是1:1
5.短周期元素M的电子层数为x,原子序数为y,已知:y = 2 x3-5x + 3,关于下列说法正确的是
A.最外层有5个电子 B.可以与金属钠形成离子化合物
C.非金属性比氧强 D.其氢化物的沸点比氧的氢化物的高
6.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是 A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.A和M为两种元素,已知A位于短周期,且![]() 与
与![]() 的电子数之差为8,则下列说法中正确的是
的电子数之差为8,则下列说法中正确的是
A.A和M原子的电子数之和可能为11
B.A和M的原子序数之差为8
C.A和M的最外层电子数之和为8
D.A和M原子的最外层电子数之差为
9.第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x元素在常温下稳定存在的氧化物一定能与烧碱反应
D.x的单质一定是良好的半导体材料
10.X、Y、Z为短周期元素,Y、Z同周期,Y原子中质子数比X原子的大5,Y的族序数比Z小4,而Z的单质分子中含34个电子。有关下列叙述中正确的
A。简单离子半径大小为Z>Y>X
B.熔点:Y、Z形成的化合物大于X、Y形成的化合物
C.X元素可形成两种常见同素异形体
D.X与Y形成的化合物既与盐酸反应又与烧碱溶液反应
11.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② D.②④ C②⑤⑥ D.①②③④
12.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。下列说法中正确的是
A.晶体中阳离子和阴离子个数不一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定大于阴离子半径
13.下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
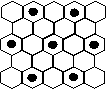
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
(⑴② ⑵PCl3或CCl4 第三周期、ⅥA族 ![]() ⑶KC8)
⑶KC8)
14.研究短周期元素形成的化合物,可以发现一些共同特点。在A、B、C、D、E五种短周期元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1∶1或2∶1形成化合物,但A、B形成化合物与C、B形成化合物的状态不同。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
(1) 画出D的原子结构简图 ____________________ 。
(2)A与B形成的化合物中,属于极性分子的化合物的化学式为____________。
(3)C与B按原子个数比为1∶1形成化合物的电子式是___________________。
(4)D、E所形成氢化物的稳定性由强到弱的顺序是___________________。
(5)由短周期元素组成的微粒,如,SO2、O3、NO2-,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是_________。
(1)
(2) H2O H2O2 (3) (4)HD>EH4 (5)CO2 N2O BeF2
15. A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是________(选填“A”或“D”);A和B的离子中,半径较小的是________________(填离子符号)。
(2)元素C在元素周期表中的位置是________。
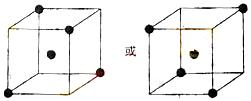
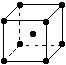
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是________。
晶胞
晶胞的![]()
(1)D ![]() (2)第三周期、ⅢA族
(2)第三周期、ⅢA族
(3)![]() (每空2分,共8分)
(每空2分,共8分)
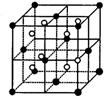
14.在晶体中具有代表性的最小重复单元,称为晶胞。右图是金属钨晶体中的一个晶胞的结构模型图(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm—3,钨的相对原子质量为183.9。假定金属钨为等直径的刚性球,请回答以下各题:
 ⑴每一个晶胞中分摊到 个钨原子。
⑴每一个晶胞中分摊到 个钨原子。
⑵计算晶胞的边长a。
⑶计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
⑷计算金属钨原子采取的体心立方结构的空间利用率。