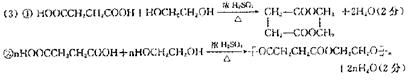高三化学寒假综合练习一
本试卷分第I卷和第Ⅱ卷共150分。考试时间120分钟。
有关的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.06年9月25日正式结束的西藏萨迦寺文物考古工作,共挖掘出元、明、清时期的各类文物900余件。在考古工作中用的较多的是13C和15N的分析方法。下列关于13C和15N的叙述正确的是
A.13C与15N具有相同的中子数
B.0.012kg 13C所含的碳原子数为阿伏加德罗常数
C.等物质的量的13C17O和15N2 ,两气体具有相同的质子数、原子数和质量
D.13C、15N和C60、N70互为同位素
2.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,
有关他们的叙述正确的是 ①互为同素异形体 ②属于同一种物质 ③富勒烯和足量氧气充分反应,最终产物不同
④富勒烯都可以发生加成反应 ⑤富勒烯在苯中溶解度比在乙醇中溶解度大
A.①②③④⑤ B.①③④⑤ C.①④⑤ D.①③④⑤
3.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl - C.Fe3+ D.NO3 -
4.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟中学课本中的一个化学反应相比拟,该化学反应是
A.CO2+H2O![]() H2CO3
B.NH3+HCl=NH4Cl
H2CO3
B.NH3+HCl=NH4Cl
C.Zn+H2SO4=ZnSO4+H2↑ D.C6H5OH+NaOH=C6H5ONa+H2O
5. 干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
| 物质 | 干燥效率 | 物质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
分析以上数据,下列有关叙述错误的是
A.MgO的干燥性能比CaO好 B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂 D.上述干燥剂中阳离子对干燥性能的影响比阴离子
6. 自然界中存在一种尖晶石,化学式为MgAl204,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g恰好与100mL一定的浓度盐酸完全反应,则该盐酸的浓度可能是
A.2.8 mol/L B. 3.2mol/L C.4.3 mol/L D. 4.9 mol/L
7.不能用胶体的知识解释的现象是
A、牛油与氢氧化钠溶液共煮,向反应后所得的液体中加入食盐,会有固体析出
B、一支钢笔使用两种不同牌号的蓝墨水,容易出现堵塞
C、向氯化铁溶液中加入NaOH溶液,会出现红褐色沉淀
D、在河水与海水的交界处,易形成三角洲
8.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]()
下列叙述不正确的是:
A.放电时负极反应为:Zn—2e- +2OH-= Zn(OH)2;
B.充电时阳极反应为:Fe(OH)3 —3e- + 5OH- = FeO42- + 4H2O;
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化;
D.放电时正极附近溶液的碱性增强。
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是
A、鉴别溶液中是否含有Br—时,所加的AgNO3溶液用硝酸酸化
B、检验C2H5Cl中含Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化
C、鉴定待测溶液中是否含有Fe2+时,用硝酸酸化
D、为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
10.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液;(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;(3)在(2)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的是
A.Na+ B.Al3+ C.CO32- D.SO42-
11.学习卤素后发现一种规律,某元素的单质或化合物通过缔合易溶于该元素的化合物中,如I2易溶于KI溶液中,HF易溶于NaF溶液中,属于上述情况的是
A.Br2易用于溴苯中 B.S易用于CS2中
C.S易溶于Na2S溶液中 D.AgF易溶于水中
12.将15 g铁粉溶于1 L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加9 g,则原溶液中硝酸的浓度为
A、1.0 mol·L-1 B、0.8 mol·L-1 C、0.6 mol·L-1 D、0.4 mol·L-1
13.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.K+、NO![]() 、SO
、SO![]() 、OH-、Na+ D. MnO
、OH-、Na+ D. MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]()
14.已知Zn(OH)2与A1(OH)3一样,是一种两性氢氧化物,它与强酸、强碱反应的
离子方程式分别为:Zn(OH)2+2H+==Zn2++2H20,Zn(OH)2+20H-==ZnO22-+2H20,
但Zn(OH)2能溶于过量的氨水中,而Al(OH)3却不能,其反应的离子方程式
为;Zn(OH)2十4NH3·H20==Zn(NH3)42++20H-+4H2O。则下面四组物质的溶液,不能运用滴加顺序进行鉴别的是:
A.A1Cl3、NH3·H20 B.ZnCl2、NH3·H20
C.A1Cl3、NaOH D.ZnCl2、NaOH
15.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
下列计算结果正确的是
A.①中溶解了5.6gFe B.硝酸的浓度为4mol/L
C.②中溶解了9.6gCu D.④中V=8960
16. 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6—
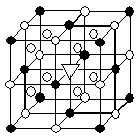 ●位于大立方体顶点和面心
●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是
A.Na+ B.Al3+
C.F— D.AlF6—
第II卷(共86分)
三.(共4题)
17.某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种。请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
| 方案 | 操作过程 | 现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
18.有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
(5)根据上述实验事实确定:①该溶液中肯定存在的离子是 ;②肯定不存在的离子是 ;③还不能确定是否存在的离子是 。
19.参看表格内容,回答下列问题:
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
⑴X、Y、Z、F分别是(写名称) 、 、 、 。
⑵G中的化学键 (填“有”或“没有”)极性。G在固态时属于 晶体
⑶Y和Z直接作用后的生成物属于 晶体。写出它的电子式 .
20.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为______。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成V02+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9g草酸,参加反应的钒元素质量是____g。
四.(共2题)
21.摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
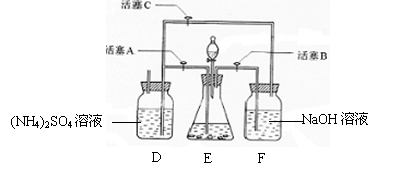
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
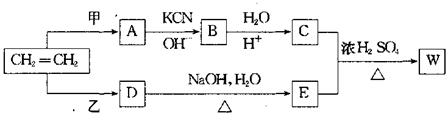
22.卤代烃R—Cl在一定条件下可发生如下反应:
R—Cl+KCN→R—CN+KCl
R—CN+2H2O+H+→R—COOH+NH4-
以乙烯为原料经过下图所示的反应可制取有机物w(A、B、C、D、E均为烃的衍生物)
|
(1)若甲为Cl2,乙为HCl,生成物W的分子式为C8H14O4,则W的结构简式为
。
(2)若W的分子式为C5H10O3,则甲为 ,乙为 。
(3)若甲、乙均为Cl2,按下列要求写出C+E→W的化学方程式:
①W为最小环状分子 。
②W为高分子 。
五.计算题
23.某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:
(1)称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mLCO2气体(标准状况)。
(2)另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO2112mL(标准状况)和0.45g水。
试通过计算,确定天然碱的化学式。
24.据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:
NaN+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:
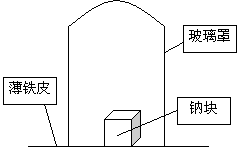 取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1000mL溶液,从中取出25.00mL溶液,和13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1000mL溶液,从中取出25.00mL溶液,和13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
高三化学寒假综合练习一
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | C | D | B | D | A | D | B |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | AC | C | B | AC | A | BD | A |
17.(8分)
| 方案 | 操作过程 | 现象和结论 |
| ① | 用洁净的铂丝分别蘸取固体样品在火焰上灼烧 | 焰色呈黄色,原样品为Na2SO4 |
| ② | 分别取少量固体放入式管中加热 | 固体逐渐变少而消失,原样品为NH4Cl |
| ③ | 分别取少量固体放入试管加适量蒸馏水溶解,用pH试纸测试 | 溶液pH小于7,原样品为NH4Cl |
| ④ | 分别取少量固体放入试管,加适量水溶解再滴加入BaCl2溶液 | 产生白色沉淀,原样品为Na2SO4 |
18.(6分)①Ba2+、I-、NH4+ ②Mg2+、Al3+、Fe3+、CO32-、SO42-、、NO3- ③K+、Na+、Cl-
19.(电子式2分,其余各1分)
(1)碳 硫 钠 过氧化钠
(2)有 分子晶体
(3)离子 Na+ [ ]2- Na+
20.(8分)⑴K2O·V2O5·2UO3·3H2O(2分)(不必考虑物质的排列顺序)
⑵1、1、1、2、1(2分) H2C2O4(2分) 0.51(2分).
21.(12分)
(1)除去混在氢气中的酸性气体(2分)
(2)A B、C (各1分,共2分)
将E中的产生的硫酸亚铁溶液压入D中(2分)
(3)②(2分)
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空2分,共4分)
22.(8分)
(1)C2H5OOCOCCH2CH2COOC2H5(2分)
|
(注:有机物结构简式写错、产物水漏写不得分,反应条件漏写或未配平扣1分。)
![]() 23.已知CO2和NaOH反应的产物可能有Na2CO3、NaHCO3或二者的混合物。题中两次实验产生CO2体积关系,可以推知天然碱中含有Na2CO3、NaHCO3成分。(1分)
23.已知CO2和NaOH反应的产物可能有Na2CO3、NaHCO3或二者的混合物。题中两次实验产生CO2体积关系,可以推知天然碱中含有Na2CO3、NaHCO3成分。(1分)
根据反应:2NaHCO3 Na2CO3+H2O↑+CO2↑
样品中:n(NaHCO3)=2n(CO2)=2×![]() =0.01mol
=0.01mol
n(H2O)=0.5×0.01mol×18g/mol=0.09g(2分)
则样品中n(Na2CO3)=![]() -0.01mol=0.02mol(2分)
-0.01mol=0.02mol(2分)
结晶水:n(H2O)=![]() (1分)
(1分)
所以,天然碱的化学式为:2Na2CO3·NaHCO3·2H2O(1分)
24.解: n(Na)=0.500 mol
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。
n(O2)=0.0100 mol
2Na2O2+2H2O==4NaOH+O2↑
0.0200 mol 0.0100 mol
Na→NaOH
c(NaOH)=0.500mo1·L-1,25 mL溶液中n(NaOH)=1.25×10—2mol
n(HCl)=1.35×10-2mol>n(NaOH),说明溶液中还有氨水。(2分)
原l L溶液中n(NH3·H2O)=40×0.100×10-2 mo1=4.00×10-2mol
Na3N+4H2O==3NaOH+NH3·H2O
4.00×10-2 mol 4.00×10-2mol
即:n(Na3N)=0.0400mo1(2分)
n(Na2O2)=0.0200mol(2分)
n(Na2O)=(0.500 mo1一0.0400 mo1×3-0.020 mo1×2)/2=0.170 mo1(2分)