高三化学普通高校招生模拟考试
化 学 试 卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23
Mg:24 Al:27 Ca:40 Fe:56 Cu:64 Zn:65 Ni:59 Pt:195
第一部分 选择题 (共70分)
一、单项选择题(本题包括10小题,每小题3分,共30。每小题只有一个选项符合题意)
1.“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在3-4年内中国人登上月球。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一。以下叙述正确的是( )
A.由质量数为3的氦原子构成的分子是双原子分子
B.23He与24He的性质均相同
C.23He、24He 形成的分子中存在共价键
D.23He中的质子数与24He的中子数相等
2.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.酒精 C.氟利昂 D.镍镉电池
3.下列“反应”中不是化学变化的是
A.显色反应 B.焰色反应 C.颜色反应 D.水解反应
 4.下列实验装置图安全正确的是
4.下列实验装置图安全正确的是
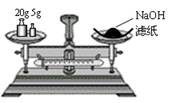
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
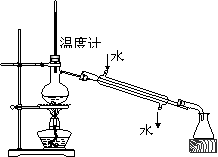
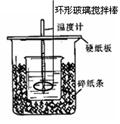
C.测定中和热 D.分离苯和甲苯
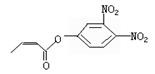
5.下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由温度不同而引起的是
①Na+O2 ②P+ Cl2 ③ C2H5OH+(浓H2SO4 ) ④Cu+HNO3 ⑤CO2+NaOH ⑥C2H2+HCl ⑦Fe+ H2SO4 ⑧Cl2+NaOH
A.①③⑧ B.②⑤⑦ C.③④⑧ D.②③⑥
6.下列各组物质的分类,正确的是
A.同位素:金刚石、石墨、C60 B.非电解质:Cl2、NH3、C2H5OH
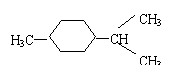
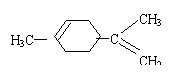
C.非极性分子:N2、CO2、CCl4 D.同系物:![]() 、
、![]() 、
、![]()
7.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g); △H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l); △H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g); △H=-283kJ/mol
8.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸钠溶液中滴加稀硫酸 B.氯化铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.酸性高锰酸钾溶液中滴加亚硫酸钠溶液
9. 某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是:
A.Cl-、Mg2+、H+、Cu2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.K+、NO![]() 、SO
、SO![]() 、OH-、Na+ D. MnO
、OH-、Na+ D. MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]()
10.反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=K![]() 式中K为常数,m、n值可用下表中数据确定之。
式中K为常数,m、n值可用下表中数据确定之。
|
|
| V(mol/L·s) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
由此可推得,m、n值正确的是
A.m=1、n=1 B.m=![]() 、n=
、n=![]() C.m=
C.m=![]() 、n=1 D.m=1、n=
、n=1 D.m=1、n= ![]()
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
![]()
![]() 11.在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
11.在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
![]()
![]()
![]() A.C
CO
CO2
Na2CO3
A.C
CO
CO2
Na2CO3
![]() B.Cu Cu(NO3)2溶液 Cu(OH)2
B.Cu Cu(NO3)2溶液 Cu(OH)2
![]()
![]()
![]() C.Fe Fe2O3 Fe2(SO4)3溶液
C.Fe Fe2O3 Fe2(SO4)3溶液
D.CaO Ca(OH)2溶液 NaOH溶液
12.现有三组溶液:① 除去含有水的植物油中的水 ② 回收碘的CCl4溶液中的CCl4 ③用食用酒精浸泡中草药提取其中的有效成份。分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
13.下列离子方程式中,正确的是
A.在氯化亚铁溶液中通入氯气Fe2++Cl2====Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O====Fe(OH)3↓+3![]()
C.碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
D.偏铝酸钠的水溶液显碱性:![]() +2H2O
+2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
14.设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
15.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为: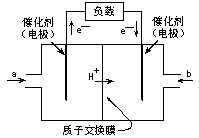 2CH3OH+3O2
2CH3OH+3O2 2CO2+4H2O
下列说法正确的是:
A.右电极(连有a的一极)为电池的正极,b处通入的物质是空气
B.左电极为电池的负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e- CO2+6H+
D.正极反应式为:O2+4e- 2O2-
16.有A、B、C、D四种一元酸的溶液,实验表明:① 物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色;② 物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液pH小于C的钠盐溶液pH;③ A酸跟D的盐反应生成A的盐和D酸.
由此可以确定四种酸的酸性由强到弱的顺序正确的是
A.B A C D B.B C A D C.D A C B D.C D A B
17.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
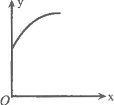 2A(g)+B(g)
2A(g)+B(g)![]() 2C(g);ΔH<0。达到平衡后,只改变一个条件(X),
2C(g);ΔH<0。达到平衡后,只改变一个条件(X),
下列量(Y)的变化一定符合图中曲线的是
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 缩小体积 | A的转化率 |
| D | 升高温度 | 混合气体密度 |
18. 已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3—) >c (Cl—) >c (Ag+)>c (I—)
B.c (K+)>c (NO3—) >c (Ag+) >c (Cl—)>c (I—)
C.c (NO3—)>c (K+)>c (Ag+) >c (Cl—)>c (I—)
D.c (K+)>c (NO3—) >c (Ag+) = c (Cl—) + c (I—)
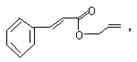 19.对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯:
19.对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯:
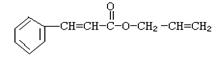 可简化为
可简化为
|
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生反应 D.均能与NaOH溶液发生反应
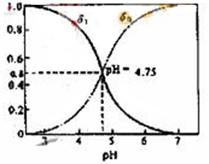 20.分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与PH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO—),则c= c(CH3COOH)+c(CH3COO—),设CH3COOH所占分配系数为δ1,CH3COO—所占分配系数为δ0,它们与PH的关系如图所示。下列有关说法正确的是
20.分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与PH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO—),则c= c(CH3COOH)+c(CH3COO—),设CH3COOH所占分配系数为δ1,CH3COO—所占分配系数为δ0,它们与PH的关系如图所示。下列有关说法正确的是
A.由曲线可知在PH为1~7时,一定有δ1+δ0=1
B.c mol/L的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液肯定显酸性
C.向CH3COOH溶液中不断滴加氢氧化钠溶液,若c(CH3COO—) >c(Na+) >c(H+)> c(OH—),则δ1一定大于δ0
D.在cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42—)=c
第二部分 非选择题 (共80分)
三、(本题包括3小题,共28分)
21.(6分)(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
③中和热测定时,一次完整实验,温度计应至少使用 次。
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
22.(10分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是______ _______________ ________ 。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___。
实验二、定量研究:
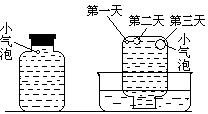
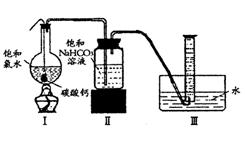 在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是________ ________ 。
 23.(12分)下面是关于硫化氢的部分文献资料
23.(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________ __________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
四、(本题包括3小题,共32分)
24.(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3![]()
Al2O3+Na2CO3![]()
(2)配平下列反应方程式,在方框内填上系数:
□FeO·Cr2O3+□Na2CO3+□O2¾□Na2CrO4+□Fe2O3+□CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程
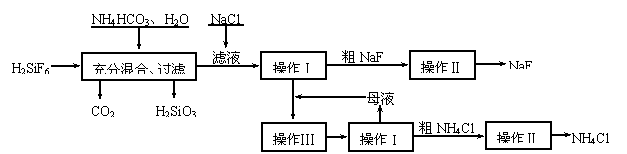
25.(10分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
![]()
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
(1)上述流程中发生两步化学反应,第一步反应的化学方程式为: ;
第二步反应能进行是因为 。
(2)操作II的作用是 。
(3)操作Ⅲ的具体过程是 。
(4)流程中NH4HCO3必须过量,其原因是 。
26.(12分)在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程。
在1L的密闭容器中,在一定条件下发生如下反应:
N2(g) +
3H2(g) ![]() 2NH3(g) ;
△H<0
2NH3(g) ;
△H<0
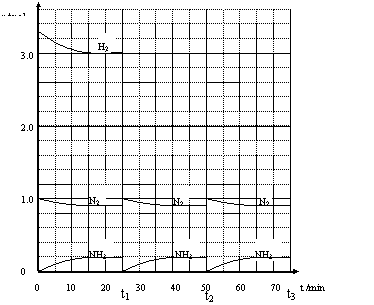
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)︰n(H2) = _ _ _︰_ _ __。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_______________________。
(2)在t1时,曲线发生变化的原因是_________________________________ ________。
请计算氢气在t1起点时的坐标(_________,________);以及在t2平衡时的坐标(_________,________)。
(3)为达到图示中t2的平衡状态,在t1~t2之间需要采取的措施是(填序号)_____ _。
a.扩大容器的体积 b.升高温度 c.降低温度 d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比
n(N2)︰n(H2) = _ _ _︰_ _ __,整个过程中N2和H2的总转化率之比
α(N2)︰α(H2) = ___ ___︰___ ___。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)︰n(H2) = _______。
五、(本题包括1小题,共10分)
27.(10分)萨罗(Salol)是一种消毒剂,它的分子式C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键):
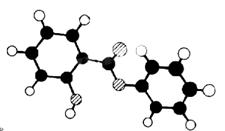
(1)根据上图模型写出萨罗的结构简式:_________________ ______。
(2)写出萨罗分子结构中含有官能团的名称: 。
(3)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸),请判断a.苯酚、b.碳酸、c.水杨酸的酸性强弱(用字母表示)。 。
(4)写出同时符合下列四种条件的水杨酸的同分异构体共有_ ______种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;
④只能生成两种一氯代产物。
(5)从(4)确定的同分异构体中任选一种,指定为下列框图中的A。
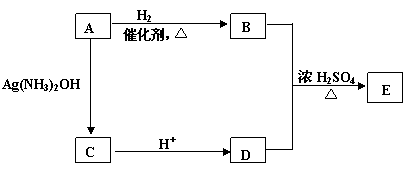

写出下列反应的化学方程式:
B+D→E: ;
该反应属于 反应。
六、(选做题,本题共10分)
考生注意:28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,如果不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
28.(10分)
 由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题:
由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题:
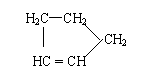
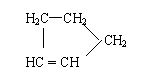 Ⅰ: 是环戊烯的结构简式,可进一步简写为 。
Ⅰ: 是环戊烯的结构简式,可进一步简写为 。
环戊烯的化学性质跟烯烃相似。
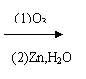 Ⅱ:有机物中烯键可发生如下反应:
Ⅱ:有机物中烯键可发生如下反应:
① (CH3)2C=CHCH3 (CH3)2C=O + CH3CH=O
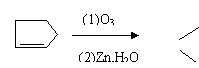 |
② CH2 CH2CHO
CH2CHO
![]() (1)写出异戊二烯(CH2=CH—C=CH2)经O3分解生成的各种产物的结构简式及物质
(1)写出异戊二烯(CH2=CH—C=CH2)经O3分解生成的各种产物的结构简式及物质
CH3
的量之比:
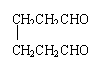 (2)写出由环己醇( )合成己二醛(
)各步反应的化学
(2)写出由环己醇( )合成己二醛(
)各步反应的化学
方程式:
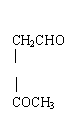
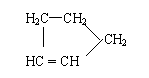
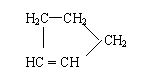
 (3)某烃A的分子式为C10H16。A经O3分解可得到等物质的量的两种产物,其结构简式
(3)某烃A的分子式为C10H16。A经O3分解可得到等物质的量的两种产物,其结构简式
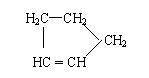
分别为HCHO和CH3COCH2CH2CH 。 A经催化加氢得产物B,B的分子式是C10H20,
且B内含有六元碳环。写出A和B的结构简式。A: B: 。
29.(10分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 (单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1) a粒子的核外电子排布式 。
(2) b与e相应元素的最高价氧化物对应水化物的碱性比较为: > (用化学式表示)。
(3) d粒子所构成的物质具有易液化的特性,推测其原因为: 。
(4) g粒子所构成的晶体类型属于 晶体。
(5) c粒子是 ,f粒子是 (用化学式表示)。
化学参考答案
选择题(共70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | B | C | A | C | D | A | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 题号 | D | C | B D | B | A C | B | A C | A | C D | A B |
三、(共28分)
21.(6分)
(1)① 锥形瓶(1分);② 胶头滴管(1分);③ 三(1分)。
(2) A→E→B→C→D (3分,全对才给分)。
22.(10分)
(1)CaCO3消耗了氯水中的HCl,使Cl2+H2O![]() HCl+HClO平衡向右移动,HClO浓度增大 (2分)
HCl+HClO平衡向右移动,HClO浓度增大 (2分)
(2) Ca(HCO3)2 (2分,写名称正确同样得分)
(3) 在导管末端再连接长导管,使导管的出口接近量筒底部 (2分)
(4) 碳酸钙与氯水反应生成的Ca(HCO3)2再受热时,除生成CO2外,还生成了CaCO3(2分)
(5)从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集 (2分)
23.(12分)
(1)硫化氢的挥发(1分)。
(2)H2S+I2==2HI+S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色(2分)。
(3)S或硫(2分)。
(4)氢硫酸被空气中氧气氧化(1分);防止因通入空气过快而使硫化氢大量挥发(2分)。
(5)硫化氢自身分解(1分);确证生成的气体是氢气(2分)。
四、(共32分)
24.(10分)
(1)SiO2+CaCO3![]() CaSiO3+CO2;Al2O3+Na2CO3
CaSiO3+CO2;Al2O3+Na2CO3![]() 2NaAlO2+CO2 (各2分)
2NaAlO2+CO2 (各2分)
(2)4FeO·Cr2O3+8Na2CO3+7O2 == 8Na2CrO4+2Fe2O3+8CO2(2分)
(3)提取可溶物质,并使AlO2-转化成Al(OH)3(2分)
有关的离子方程是: AlO2-+H++H2O == Al(OH)3 ¯(2分)
25.(12分)
(1)H2SiF6+6NH4HCO3+H2O=6NH4F+H2SiO3↓+6CO2↑ (2分);
一定条件下,NaF比NaCl、NH4Cl、NH4F的溶解度小(2分)。
(2)除去NaF 、NH4Cl 表面的杂质(2分)。
(3)加热蒸发溶剂,析出少量晶体后冷却结晶(2分)。
(4) 必须保证H2SiF6能全部反应,防止在进行反应Ⅱ时H2SiF6将与NaCl反应,生成Na2SiF6沉淀,混入NaF中影响NaF质量;同时过量的相对廉价原料NH4HCO3可以提高H2SiF6的转化率。(2分)。
26.(12分)
(1)1∶3.3(1分); 0.02 mol·L-1·min-1(1分)。
(2)分离氨气、补充物质的量之比为n(N2)∶n(H2)=1∶3.3的氮气和氢气(2分);
(25,3.33) (1分);(50,3.03)(1分);
(3)a、b (2分)。
(4)n(N2)∶n(H2)=3∶11(1分);
a(N2)∶a(H2)=11∶10 (1分)。
(5)n(N2)∶n(H2)=1∶3 (2分)。
五、(共10分)
27.(10分)
(1)
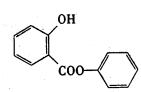 (2分)
(2分)
(2)酚羟基、酯基、苯环 (2分)。 (3)c>b>a (1分)。 (4)2 (2分)。
(5)
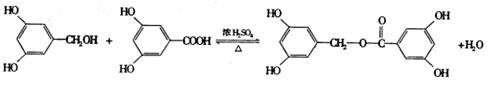 (2分)
(2分)
(如选用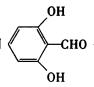 作为A写入方程式同样给分);
取代(或酯化)反应 (1分)。
作为A写入方程式同样给分);
取代(或酯化)反应 (1分)。
六、(选做题,共10分)
28.(10分)
(1)n(HCHO)∶n(CH3COCHO)= 2∶1
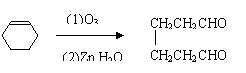
| |
| |
(每空2分)
29.(10分)
(1)1s22s22p6 (2分)
(2)NaOH > Mg(OH)2 (2分)
(3)NH3分子间能形成氢键,使NH3的沸点较高 (2分)
(4)分子 (2分)
(5)OH—,H3O+ (各1分)