高三化学第一轮复习――有机化学单元测试题
本试卷分第I卷和第Ⅱ卷两部分共150分,考试时间120分钟
可能用到的相对原子质量:C—12 H—l O—16 S—32 F—19 N—14 Na—23
第I卷(选择题,共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.“喷水溶液法”是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它先在沙漠上喷洒一定量聚丙烯酯水溶液,水溶液中高分子与沙土粒子结合,在地表下30—52cm处形成一厚0.5cm的隔水层,既能阻止地下的盐分上升,又有在表层蓄积雨水的作用。下列对聚丙烯酸酯的说法不正确的是 ( )
A.单体的结构可表示为 CH2=CHCOOR B.在一定条件下能发生加成反应
C.在一定条件下能发生水解反应 D.没有固定的熔沸点
2.生活中的一些问题常涉及化学知识,下列叙述不正确的是 ( )
A.糯米中的淀粉一经发生水解反应,就酿造成酒
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和人造丝的主要成分都是纤维素
D.室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
3.若液氨相当于地球上的水,它可满足木星上生物生存的需要,那么木星上生物体内与地球上生物体内葡萄糖的分子结构相当的化合物是 ( )
A.CH2OH—(CHOH)4CHO B.CH2NH2—(CHNH2)4CHO
C.CH2NH2—(CHNH2)4CH=NH D.CH2OH—(CHOH)4CH=NH
4.下列各组有机物中,既不互为同系物,又不互为同分异构体的是 ( D )
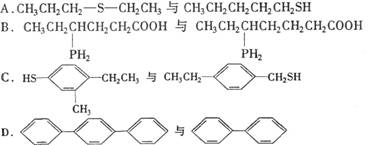 |
5.已知化合物A(![]() )与立方烷(
)与立方烷(![]() )的分子结构相似,如下图:
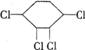
)的分子结构相似,如下图:
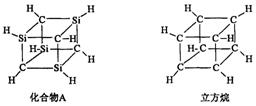
则![]() 的二氯代物的同分异构体数目为
的二氯代物的同分异构体数目为
A.3 B.4 C.5 D.6
![]() 6.已知氯乙烷跟氢氧化钠醇溶液共热可得乙烯,现由
制取
其中
6.已知氯乙烷跟氢氧化钠醇溶液共热可得乙烯,现由
制取
其中
所涉及加成反应和消去反应的次数为 ( )
A.2,2 B.3,3 C.2,3 D.3,2
 |
7.某有机物的结构简式为 可发生反应类型的组合是 ( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚
A.①②③⑤⑥ B.②③④⑥⑧ C.①②③⑤⑥⑦ D.③④⑤⑥⑦⑧
8.能在有机物的分子中引入羟基官能团的反应类型有:①酯化反应,②取代反应,③消去反应,④加成反应,⑤水解反应,⑥还原反应。其中正确的组合有C
A.①②③ B.②④⑤ C.②④⑤⑥ D.②③④⑤⑥
9.下列实验室常用试剂:①酚酞试液 ②银氨溶液 ③稀H2SO4 ④FeCl3溶液(加少量HCl) ⑤氢硫酸 ⑥苯酚溶液 ⑦Na2CO3溶液 ⑧石灰水,其中不宜长期放置的试剂是D
A.②④⑤⑧ B.①②④⑥⑧ C.②③⑤⑦ D.②⑤⑥⑧
10.恐怖分子使用的“沙林”是剧毒的神经毒剂,其化学名称为甲氟磷酸异丙酯.已知甲氟磷酸的结构式为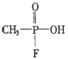 ,则“沙林”的结构简式是
,则“沙林”的结构简式是
A.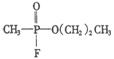 B.
B.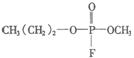
C.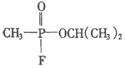 D.
D.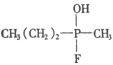
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米和日本科学家白川英树,以表彰他们发现有关导电聚合物的功劳。他们研究发现:经过特殊改造后的塑料能够像金属一样具有导电性能。以聚乙炔为例,要使其能导电,必须用I2和Na等作掺杂处理,它们的掺杂实验通式如下:
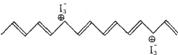 ①[CH]n+3x/2I2→[CH]nx++xI3-;②[CH]n+xNa→[CH]nx-+xNa+。其中,用I2掺杂后的聚乙炔结构式如下图
①[CH]n+3x/2I2→[CH]nx++xI3-;②[CH]n+xNa→[CH]nx-+xNa+。其中,用I2掺杂后的聚乙炔结构式如下图
根据上述事实回答11-12题:
11.根据用I2掺杂后的聚乙炔结构式判断,下列说法不正确的是 ( )
A.在未经掺杂的聚乙炔结构中,碳原子之间是以单双键交替形式形成的
B.掺杂后的聚乙炔结构中,单双键交替形式不变
C.掺杂后的聚乙炔,其局部结构被破坏
D.掺杂后的聚乙炔之所以能够导电,是因为它类似一种盐,成为具有可移动电荷的载体
12.下列说法正确的是 ( )
A.该掺杂反应为氧化还原反应
B.该掺杂反应不是氧化还原反应
C.掺杂反应①中,聚乙炔被还原;掺杂反应②中,聚乙炔被氧化
D.在掺杂反应①②中,转移电子数都为xe-
![]() 13.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物:
13.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物:
有光学活性,分别发生下列反应:①与甲酸发生酯化反应;②与NaOH水溶液共热;③与银氨溶液作用;④在催化剂存在下与H2作用。生成的有机物中无光学活性的是 ( )
A.①②④ B.②③④ C.①②③ D.①③④
14.某种药物主要成分X的分子结构为 ,关于有机物X的说法中,错误的是 ( )
A.X难溶于水,易溶于有机溶剂 B.X能跟溴水反应
C.X能使酸性高锰酸钾溶液褪色 D.X的水解产物能发生消去反应
15.有机物的分子组成与碳原子数相同的开链烷烃的分子组成相比较,前者每减少两个氢原子,
则增加一个不饱和度。已知C=C、C=O的不饱和度均为1。现有结构式为 的物质,通过碳和氧原子数及不饱和度的计算,确定下列物质中,不是上述物质的同分异构体的是
( AD )
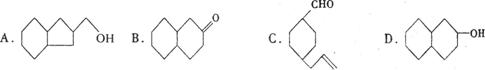 |
16.使1-丙醇在不同条件下脱氢,从理论上分析,其脱氢产物可能有 ( )
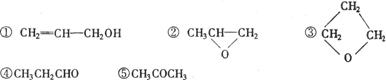 |
A.只有① B.只有①④ C.全部 D.①②③④
17.在120℃,1.01×105Pa时,1 L C3H8和一定量的氧气混合后点燃,充分作用后生成水和碳的氧化物气体,恢复到原温度和压强后,测得气体体积为mL,混合气体通过足量碱石灰后,气体体积为nL,若m-n=6,则原来通入O2的体积为(同温同压) ( )
A.5.5L B.5L C.4.5L D.4L
18.分别燃烧等物质的量的下列各组物质,其中耗氧量相等的是 ( )
①C2H2与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6 ④HCOOCH3与CH3COOH
A.①②③④ B.①②④ C.①④ D.②④
19.跟醛基相连的碳称作α—碳,其上面的氢称α—氢。已知含α—氢的醛可在稀碱作用下发
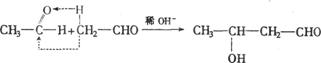 |
生羟醛缩合反应生成β—羟基醛,如
现有甲醛、乙醛、丙醛三种醛混合在稀碱中发生以上反应,推知生成β—羟基醛的数目为
A.9种 B.6种 C.4种 D.3种
20.环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是
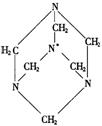 A.分子中所有的N,C原子共面
A.分子中所有的N,C原子共面
B.结构式中打*的N原子处于分子的中心
C.分子中含有3个相同的C,N交替排列的六元环
D.连接分子中的4个N原子可构成一个正四面体
第Ⅱ卷(非选择题,共80分)
三、(本题包括3小题,共38分)
21.(6分)
I.对以下课本中的各实验:A.浓硫酸跟乙醇反应制乙烯 B.乙醛还原新制的氢氧化铜C.乙酸乙酯的制取 D.石油的蒸馏 E.葡萄糖的银镜反应 F.乙酸乙酯的水解 G.中和热的测定。
按下列各操作的要求,用字母A、B、C……填空:
(1)需用水浴加热的是 。
(2)为防止液体暴沸,常需要加少量碎瓷片的是 。
(3)需用温度计的是 。
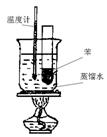 II.(4分)某同学为验证苯的沸点(80.1℃)比水低,设计了如图
II.(4分)某同学为验证苯的沸点(80.1℃)比水低,设计了如图
所示的实验装置(某些固定装置已略去):
(1)能够说明苯的沸点比水低的实验现象是
________________________________________________
(2)使用该实验装置有一个明显的缺点是难以控制苯蒸气的
大量外逸,试对该装置加以改进(用适当文字加以说明)
________________________________________________。
III.(8分)含碳、氢、氧元素的下列有机物分子式通式:
A.![]() B.
B.![]() C.
C.![]()
D.![]() E.
E.![]() F.
F.![]()
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的 (填代号)。
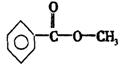
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式 ;若该有机物属于酯类且分子中含有苯环.则其可能的同分异构体有 _种,写出其中不能发生银镜反应的同分异构体的结构简式 。
22.(8分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓人十几次反应基本完全。有关物质的沸点见下:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 197.2 | 100 |
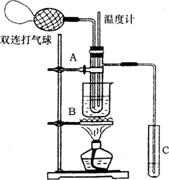 请回答下列问题:
请回答下列问题:
(1)试管A在60~80℃时发生的主要反应的化学方程式
为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管
A内的位置,在实验开始时温度计水银球的位置应在
;当试管A内的主要反应完成后温度
计水银球的位置应在 ,
目的是 。
(3)烧杯B的作用是 ;烧杯B
内盛装的液体可以是
(写出一种即可)。
(4)若想检验试管C中是否含产物乙酸,请你在所提供的药品中选择,设计一个简便的实验方案。
所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。
该方案为 。
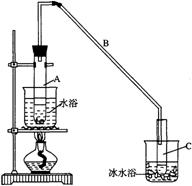 23.(12分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯,
23.(12分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯,
已知: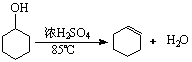
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是__________。
②试管C置于冰水浴中的目的是___________________________________________。
(2)制备精品
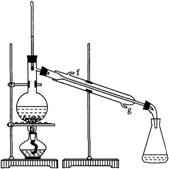 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用______(填入编号)洗涤。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
五、(本题包括2小题,共18分)
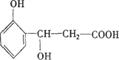
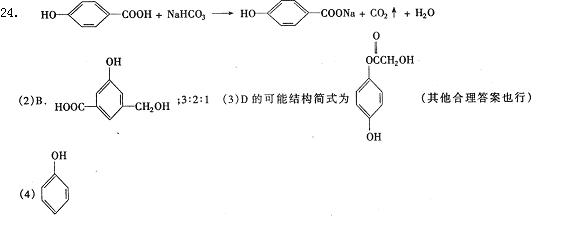
24.(10分)A、B、C、D均为芳香族化合物,且式量B>A>C,已知有机物A的结构简式为:
![]() HO— —COOH。
HO— —COOH。
(1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和
NaHCO3溶液反应的化学方程式 。
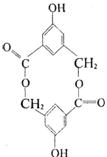
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯如右
图:写出B的结构简式 ;等物
质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、
NaHCO3的物质的量之比为 。
(3)D与B互为同分异构体,苯环上一氯取代物只有两种,D不与
NaHCO3反应,能与Na与NaOH反应,等质量D消耗Na、NaOH物质的量之比为2:3,则D的可能结构简式为 。
(4)1mol A、C完全燃烧,消耗氧气的质量相等,且1mol C能和1mol Na完全反应,写出含碳原子数最少的C的结构简式 。
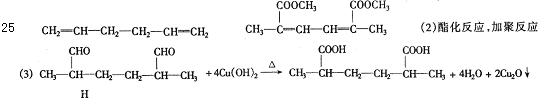
25.(8分)已知:
摩尔质量:RCH=CH2 为(R+27)g/mol,RCH(CH3)CHO为(R+57)g/mol。今有A、B、C、
D、E、F六种有机化合物,它们都只含C、H、O三种元素,这六种有机物之间的转化关系为:
其中A和D的摩尔质量分别为82g/mol和202g/mol。A是无支链的烃,B可发生银镜反应,C可被碱中和,D无酸性;而F是高分子化合物,其分子式为(C10Hl4O4)n。试回答:
(1)写出A、E的结构简式:A ;E: 。
(2)C→D的反应类型是 ;E→F的反应类型是 。
(3)写出B与足量的新制Cu(OH)2碱性悬浊液反应的化学方程式:
。
六、(本题包括2小题,共24分)
26.(10分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
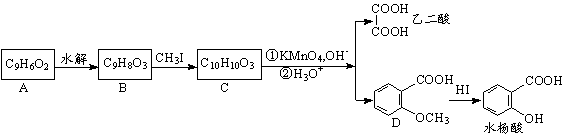
提示:①CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
②R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
请回答下列问题:
(1)写出化合物C的结构简式 。
(2)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有 种。
(3)在上述转化过程中,反应步骤B→C的目的是 。
(4)请设计合理方案从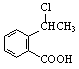 合成
合成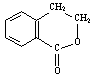 (用反应流程图表示,并注明反应条件)
(用反应流程图表示,并注明反应条件)
例:由乙醇合成乙烯的反应流程图可表示为:
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
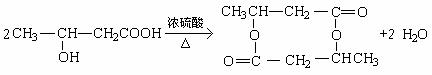
27. (14分)已知:
|
|
![]()
![]()
![]()
![]()
![]() R—CH2—C—CH2—R’
R—CH2—C—CH2—R’
|
|
|
|
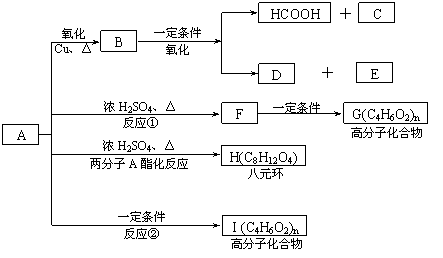 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式:A____________C____________D____________。
(2)反应①和②的反应类型:反应①____________ 反应②____________
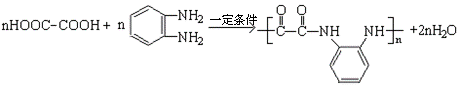
(3)写出下列变化的化学方程式:
![]() ①E与邻苯二胺(
)缩聚生成一种合成纤维:
①E与邻苯二胺(
)缩聚生成一种合成纤维:
②F→G_________________________________________________
③A→H_________________________________________________
高三化学第一轮复习――有机化学单元测试题参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | C | D | B | D | C | C | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | AD | A | BD | AD | D | C | B | B | D |
21.I.(1)E、F (2)ACD (3)ADFG II.(1)烧杯中的水尚未沸腾时,试管中的苯已沸腾 (2分)
(2)在试管口上加装带有长玻璃导管的单孔塞(冷凝回流) (2分)
III. (8分)(1)D (2分)
(2)![]() 6
6 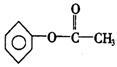
![]() 22.(1)2CH3CHO+O2 2CH3COOH。(2)第一阶段时,乙醛氧化成乙酸,温度计用于控制反应温度,所以温度计下端应浸入试管A的反应液中。第二阶段是将生成的乙酸用蒸馏方法分离出来,温度计的作用是控制馏分的温度,略低于试管A的支管口处收集含乙酸的馏分。
22.(1)2CH3CHO+O2 2CH3COOH。(2)第一阶段时,乙醛氧化成乙酸,温度计用于控制反应温度,所以温度计下端应浸入试管A的反应液中。第二阶段是将生成的乙酸用蒸馏方法分离出来,温度计的作用是控制馏分的温度,略低于试管A的支管口处收集含乙酸的馏分。
(3)烧杯B的作用类似于水浴加热,可使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;由于第二阶段时要将乙酸蒸馏出来,所以B中液体的沸点应超过117.9℃,所以可选用乙二醇或甘油。(4)乙醛溶液显中性,乙酸溶液显酸性,可利用这一原理设计实验来检验有无乙酸生成。方法一:将少量碳酸氢钠粉末,放人一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较确定溶液的pH,进而说明是否有乙酸生成。
23.(1)①防止暴沸(其它合理答案也可) 冷凝 ②防止环己烯的挥发(其它合理答案也可)
(2)①上 C ②g 除去水分 ③83℃ C
(3)B、C(最后两空各2分,其余各1分)
26.
(1)![]() (2分) (2)9种(2分) (3)保护酚羟基,使之不被氧化(2分)
(2分) (2)9种(2分) (3)保护酚羟基,使之不被氧化(2分)
(4)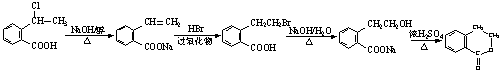 (4分)
(4分)
27.(14分,方程式每个2分)
(1)A:CH3—CH(OH)—CH2—COOH C:HOOC—CH2—COOH D:CH3COOH
(2)消去,缩聚(各1分,共2分,答聚合也给分)
 |
(3)①
 |
②
 |
③