高三化学二卷典型题训练五
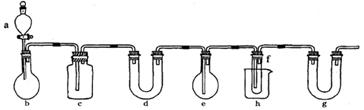 1、PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。
1、PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。
|
| 熔点 | 沸点 |
| 三氯化磷 | -112℃ | 76℃ |
| 五氯化磷 | 148℃ | 200℃分解 |
三氯化磷和五氯化磷的物理常数如下:
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。请据此回答下列问题:
(1)写出b中发生反应的化学方程式:_____________。
(2)氯气和白磷反应放出大量的热,为使仪器e不致因局部过热而炸裂,实验开始前应在e的底部放少量_______。
(3)在烧杯h中加入冰盐水,其作用是_________________________________。
(4)C中所盛装的试剂是_______,其作用是_______________________________。
(5)实验室将白磷保存于水中,取出的白磷用滤纸初步吸去表面水分,然后浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知酒精与乙醚互溶,乙醚易挥发。用上述方法除去水分的原因是____________________。
(1)4HCl(浓)+MnO2====MnCl2+Cl2↑+2H2O(2)细沙(3)冷凝PCl3蒸气(或使三氯化磷蒸气充分冷凝)
(4)饱和NaCl溶液;吸收Cl2的HCl气体 碱石灰;防止空气中水蒸气进入e中使PCl3水解,同时吸收Cl2防止污染空气(5)白磷上残留的水溶解在酒精中,残留的酒精又溶解在乙醚中,乙醚容易挥发,从而完全除去水分。
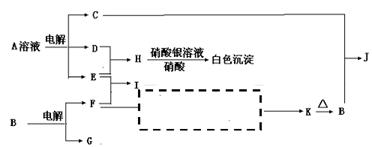 2、反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A~J中的物质:
2、反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A~J中的物质:
(1)A的电子式 ,
H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
(3)请设计F→K的最佳途径

(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是
|
4. (1)![]() H—Cl (2)
2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
H—Cl (2)
2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
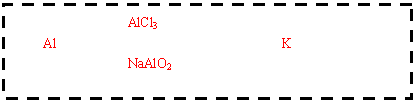 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
 3、Ag/α-Al2O3中石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂回收实验如下图所示。其中的转化反应为:
3、Ag/α-Al2O3中石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂回收实验如下图所示。其中的转化反应为:
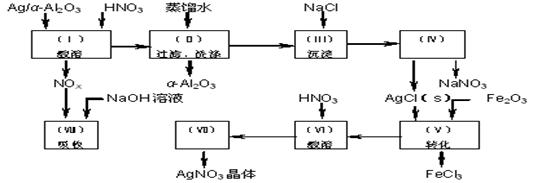 6AgCl + Fe2O3→3Ag2O + 2FeCl3
6AgCl + Fe2O3→3Ag2O + 2FeCl3
阅读上述实验流程,完成下列填空:
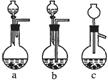
⑴Ag/α-Al2O3加酸溶解应该选用右图装置 (选填a、b、c)。
⑵在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式 。
⑶实验操作(Ⅳ)所需玻璃仪器为(填写三种) 。
⑷在实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为: 。
①蒸馏 ②蒸发 ③灼烧 ④过滤 ⑤冷却结晶
⑸已知:NO + NO2 + 2NaOH →2NaNO2 + H2O;2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O。 NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为 。
a. x≤1.5 b. x=1.2 c. x≥1.5
⑹已知Ag/α-Al2O3中Ag的质量分数计算Ag的回收率,还必须知道的实验数据为 和 。
答案⑴a ⑵Ag++ Cl- = AgCl↓ ⑶漏斗、烧杯、玻璃棒 ⑷②⑤④⑸c ⑹催化剂的质量 AgNO3(s)的质量
4、“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中加热的目的是 ;趁热过滤的目的是 。
⑶将步骤④还缺少的操作是 ,所用的主要仪器是 。
答案:⑴用玻璃棒蘸取溶液,点滴在pH试纸中央,与标准比色卡对照 取最后一次洗涤液,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净
⑵促使Fe3+完全水解 减少ZnSO4的损失,除去Fe (OH)3沉淀
⑶将溶液小心加热浓缩,冷却结晶 蒸发皿,酒精灯,铁架台,玻璃棒
5、某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂
是_______________,反应的离子方程式为_________________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
 Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
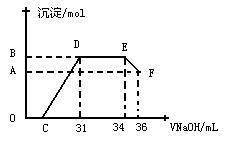
的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______________________。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;
上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
(4) B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为_____mL。
Ⅰ ⑴合理 ⑵NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑ ⑶B
Ⅱ ⑴H++OH-=H2O ⑵ NH4++OH-=NH3·H2O Al3+、Fe3+、H+,NH4+;
⑶0.008 ⑷0.032mol 7mL