高三化学二轮复习分子结构专项练习
1、下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )
A. CO2 B. PCl3 C. CCl4 D. NO2
2、下列分子中所有原子都满足最外层8电子结构的是 ( )
A. 光气(COCl2) B. 六氟化硫 C. 二氟化氙 D. 三氟化硼
3、下列各分子中所有原子都满足最外层为8电子结构的是 ( )
A. BeCl2 B. CF2Cl2 C. PCl5 D. N2
4、下列各分子中,所有原子都满足最外层为8电子结构的是( )
A. H2O B. BF3 C. SiCl4 D. C6H6
5.下列分子所含电子总数与氩原子不相同的是
A.F2 B.CH3OH C.SO2 D.N2H4
![]() 6.下列分子有极性的是
6.下列分子有极性的是
A.CH≡CH B. C.CH3Cl D.N2
7. 下列分子中,属于含有极性键的非极性分子的是
A. H2O B. Cl2 C. NH3 D. CCl4
8.下列物质中,含极性键和非极性键且分子有极性的是
A.乙烯 B.乙醛 C.甲醇 D.三氯甲烷
9.下列说法正确的是()
A.离子化合物一定没有共价键 B.极性分子中一定没有非极性键
C.BeCl2和PCl3的分子中所有原子都满足8电子的稳定结构
D.相同质量的N2和CO的核外电子总数相同
10、下列说法中,正确的是( )
A 离子化合物中一定没有共价键 B 失电子难的原子获得电子的能力一定强
C 化学反应中,某元素由化合态变为游离态,该元素被还原
D 电子层结构相同的不同离子,其半径随核电荷数增多而减小
11、下列有关叙述正确的是( )
A 已知NaH是离子化合物,则NaH的电子式是Na+[:H]-
B 固体PCl3为分子品体,分子中存在Cl—Cl非极性键
C 在BCl3分子中,所有原子都满足最外层8电子结构
D 石墨晶体是层状结构,在同一层上平均每个正六边形所含的碳原子数为2
12、下列说法正确的是①一切原子都由质子、中子、电子组成②凡质量数相同的原子化学性质必定相同③两种微粒结构中,如核外电子排布相同,其化学性质一定相同④两种原子的核外电子排布相同,则它们一定属于同种元素⑤单原子形成的离子一定具有稀有气体的电子层结构
A 全部正确 B ②③ C ③⑤ D ④
13、下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大者为
A LiCl B Na2S C NaF D MgO
14.对于X—O—H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是( )
A.当X是活泼金属时,它一定是强碱
B.当X是非金属性很强的元素时,X—O—H一定是强酸
C.X—O—H的水溶液不能导电 D.X—O—H一定是共价化合物
15.科学家正拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。关于这种分子的下列说法,正确的是
A.它是两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
16 .最新科技报道,美国夏威夷联合中心的科学家发现了新型氢粒子,这种新粒子是由3个氢原子核(只有质子)和2个电子构成,对于这种粒子,下列说法正确的是
A.这种粒子含有3个质子 B.它的组成可以表示为H3
C.这种粒子含有3个中子 D.是氢的一种新的同位素
17下列说法中正确的是
A.由同种元素组成的物质一定是纯净物
B.由两种元素组成的分子中一定不存在非极性共价键
C.含有离子键的化合物一定是离子化合物
D.含有极性共价键的分子一定是极性分子
18下列说法中正确的是
A.酸性氧化物都是非金属氧化物 B.所有物质中都存在化学键
C.含有极性键的分子一定是极性分子 D.含有离子键的化合物一定是离子化合物
19.下列指定微粒的个数比为2∶1的是
A. Be2+离子中的质子和电子 B. 2H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. BaO2(过氧化钡)固体中的阴离子和阳离子
20由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,下列说法中正确的是
A.晶体中阳离子和阴离子个数一定相等 B.晶体中一定只有离子键没有共价健
C.所含元素一定不在同一周期也不在第一周期 D.其中阳离子半径一定大于阴离子半径
21下列化学式既能表示物质的组成,又能表示物质分子式的是
A. NaCl B. CO2 C.SiO2 D.Cu
22、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是
A、NH4Cl=NH3↑+ HCl↑ B、NH3+CO2+H2O=NH4HCO3
C、2NaOH+Cl2=NaCl+NaClO+H2O D、2Na2O2+2 CO2=2Na2CO3+O2
23、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A、C3N4晶体是分子晶体
B、C3N4晶体中,C— N键的键长比金刚石中的C—C键长要长
C、C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D、C3N4晶体中微粒间通过离子键结合
 24.最近发现一种由M、N两种原子构成的气态团簇分子,如图所示。 实心球●表示N原子,空心球○表示M原子,它的化学式为
24.最近发现一种由M、N两种原子构成的气态团簇分子,如图所示。 实心球●表示N原子,空心球○表示M原子,它的化学式为
A.M4N4 B.MN
C.M13N14 D.M4N5
横车高中高三化学练习 晶体结构
1、下列关于氢键的说法,正确的是( )
A .每个水分子内含有两个氢键
B .冰、水和蒸气分子间都存在氢键
C. DNA中的碱基互补配对是通过氢键来实现的
D. 水是一种非常稳定的化合物,这是由于氢键所致
2、下列事实与氢键有关的是 ( )
A. 水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.H1F、HCl、HBr、HI 的热稳定性依次减弱
3.下列可用氢键来解释的是
A.浓的氢氟酸溶液中存在HF2-和H2F3-
B.SiH4沸点比CH4高
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.H2O比H2S稳定,前者1000oC以上才分解,后者300 oC分解
4 下列物质中,属于原子晶体的是
A.石英 B.干冰 C.食盐 D.冰
5 在固态及熔融状态下均能导电的晶体是
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
6.下列叙述正确的是
A.由非金属元素组成的化合物一定是共价化合物C.晶体熔化时化学键不一定发生断裂
B.含有金属元素的化合物一定是离子化合物 D.原子晶体的熔点一定比金属晶体高
7 下列叙述正确的是( )
A.离子晶体中一定不含有非极性共价键 B.分子晶体中一定含有极性共价键
C.冰主要是通过水分子间氢键作用形成的 D.化学式相同的物质,其熔沸点一定相同
8 下列有关物质的结构或性质的叙述错误的是
A.水是一种非常稳定的化合物,这是由于氢键所致
B.由极性键形成的分子不一定是极性分子
C.H2O、HF、NH3、CH4的沸点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
9.有关晶体的下列说法中正确的是
A. 晶体中分子间作用力越大,分子越稳定 B. 原子晶体中共价键越强,熔点越高
C. 冰熔化时水分子中共价键发生断裂 D. 氯化钠熔化时离子键未被破坏
10.下列说法正确的是
A.极性分子可能是离子化合物,也可能是共价化合物。
B.晶体中只要有阳离子,就一定有阴离子,只要有阴离子,也一定有阳离子
C.在熔化状态和水溶液中均不能导电的物质称为非电解质
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
11 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
12下列有关晶体的说法正确的是
A.金属晶体是由金属离子间的相互作用形成的
B.冰熔化时,水分子中的共价键发生断裂
C.白磷为分子晶体,分子结构为正四面体,其键角时109°28′
D.固体不导电,但熔融状态下和溶于水能导电不可能是分子晶体的性质
13 根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是
| NaCl | AlCl3 | SiCl4 | 单质B | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2300℃ |
| 沸点 | 1465℃ | 183℃ | 57℃ | 2500℃ |
A.SiCl4形成的是分子晶体 B.单质B可能是原子晶体
C.电解NaCl水溶液可制得金属钠 D.不能用电解熔化AlCl3制取单质铝
14 下列有关晶体的说法正确的是
A.金属晶体是由金属离子间的相互作用形成的
B.冰熔化时,水分子中的共价键发生断裂
C.白磷为分子晶体,分子结构为正四面体,其键角时109°28′
D.固体不导电,但熔融状态下和溶于水能导电不可能是分子晶体的性质
15 有关晶体的说法中,错误的是
A.碳、硅为同主族元素,故CO2与SiO2结构相似,晶体类型相同
B.在NaCl晶体中,每个钠离子周围紧邻6个氯离子
C.由C60构成的晶体属于分子晶体,熔、沸点较低
D.在金刚石的晶体结构中,由共价键形成的最小碳环为六元环
16.下列有关说法中,错误的是
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
![]() D.CaC2的电子式为
D.CaC2的电子式为
17 下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D.KI、I2、Hg、O2
18 下列物质性质变化规律正确的是
A.金属Na、Mg、Al的硬度依次降低 B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低 D.O、F、H的原子半径依次减小
19下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
 B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时.破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
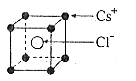
20 已知如图CsCl晶体的密度为![]() ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
A. ![]() B.
B.![]() C.
C. ![]() D.
D.![]()