高三化学二轮复习电离平衡测试题
1.下列物质的水溶液能导电但属于非电解质的是(00上海)
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2
2. 从下列现象可以判断某酸是强酸的是 (01春季)
A.加热该酸至沸腾也不分解 B.该酸可以分解石灰石放出CO2
C.该酸可以把Al(OH)3沉淀溶解 D.该酸浓度为0.1 mol/L时的pH为 1
3.下列事实可证明氨水是弱碱的是 (02春季)
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B.铵盐受热易分解
C.0.1 mol/L氨水可以便酚酞试液变红 D.0.1 mol/L氯化铵溶液的pH约为5
4.甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol / L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10 mol / L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 (04广东)
A、a的浓度必小于乙酸的浓度 B、a的浓度必大于乙酸的浓度
C、b的浓度必小于乙酸的浓度 D、b的浓度必大于乙酸的浓度
5.相同温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.c (H+) C.c (OH-) D.c (CH3COOH)
6.常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液中一定有C(OH-) = 0.1mol/L D.该溶液的pH值为1或13
7. PH=1的两种一元酸HX和HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是
A.HX可能是强酸 B.HY一定是强酸
C.HX的酸性强于HY的酸性 D.反应开始时二者生成H2的速率相等
8.将0.1 mol / L的醋酸溶液加水稀释,下列说法正确的是 (04湖)
A. 溶液中c(H+)和c(OH-)都减少 B. 溶液中c(H+)增加
C. 醋酸电离平衡向左移动 D. 溶液的pH增大
9.用水稀释0.1mol·L—1氨水时,溶液中随着水量的增加而减小的是
A.c(OH—)/(NH3·H2O) B.c(NH3·H2O)/c(OH—)
C.c(H+)和c(OH—)的乘积 D.OH—的物质的量
10(06全国Ⅱ)将纯水加热至较高温度,下列叙述正确的是:
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
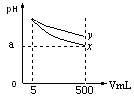 11. pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其
11. pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其
pH与溶液体积(V)的关系如图所示,下列说法正确的是
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
12.(06广东)室温时,将x mL pH=a 的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
13. PH=5的H2SO4溶液稀释500倍后,溶液中c(H+):c(SO42--)约为
A.1:2 B.1:5 C.1:10 D.10:1
14、在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是 (99试测)
A ①=④>③=② B ④=①>③>② C ①>④>③>② D ④>①>③>②
15.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是 (04湖)
A. Na2CO3、NaHCO3、NaCl、NH4Cl B. Na2CO3、NaHCO3、NH4Cl、NaCl
C. (NH4)2SO4、NH4Cl、NaNO3、Na2S D. NH4Cl、(NH4)2SO4、Na2S、NaNO3
16.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应(00广东)
17.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
18.用0.01mol·L-1NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液体积最大的是 (03理科)
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
19.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液。当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是 ( )
A. V1>V2 B. V1<V2 C. V1=V2 D. V1≤V2 (04江苏)
20.以下是几种酸碱指示剂变色的pH范围:甲基橙3.1~4.4,甲基红4.4~6.2,酚酞8.2~10,现用0.100 0 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂(03春)
A. 都可以用 B. 只能用③ C. 可以用①或② D. 可以用②或③
21.常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是
A.4 B.4.6 C.5.4 D.6
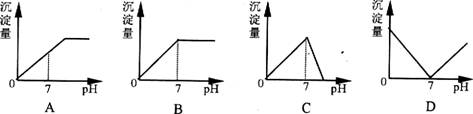
22.向盛有NaHSO4溶液的烧杯中不断加入Ba(OH)2溶液,随着Ba(OH)2的不断加入,溶液中产生沉淀量与溶液的pH变化情况正确的是A
23.常温下,某水溶液中含有的离子浓度为c(Na+)=xmol/L、c(SO42-)=0.15mol/L、c(K+)=0.2mol/L、c(Cl-)=0.45mol/L、c(Mg2+)=0.25mol/L、c(NO3-)=0.25mol/L、
c(OH-)=10-13mol/L.则x值为
A.0.2 B.0.3 C.0.4 D.0.1
离子浓度大小比较
(一)单一溶液
1.在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是( )
A.c(NH3·H2O)>c(OH―)>c(NH4+)>c(H+) B.c(NH4+)>c(NH3·H2O)>c(OH―)>c(H+)
C.c(NH3·H2O)>c(NH4+)>c(OH―)>c(H+) D.c(NH3·H2O)>c(NH4+)>c(H+)>c(OH―)
2.在氯化铵溶液中,下列关系式正确的是 ( )
A.c(Cl―)>c(NH4+)>c(H+)>c(OH―) B.c(NH4+)>c(Cl―)> c(H+)>c(OH―)
C.c(Cl―)=c(NH4+)>c(H+)=c(OH―) D.c(Cl―)=c(NH4+)>c(H+)>c(OH―)
3.已知0.1 mol / L 的二元酸H2A溶液的pH=4.0,则下列说法中正确的是 (04北京)
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2 c(A2-)
D. 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
4(96上海)物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
(二)混合溶液
1、酸与碱的混合液
(1)物质的量浓度相等的强酸(弱酸)与弱碱(强碱)等体积混合
5. 0.1mol••L―1CH3COOH溶液和0.1mol•L―1NaOH等体积混合后离子浓度的关系正确的是
A.c(CH3COO―)>c(Na+)>c(OH―)>c(H+) B.c(Na+)>c(CH3COO―)>c(OH―)>c(H+)
C.c(Na+)>c(CH3COO―)>c(H+)>c(OH―) D.c(Na+)=c(CH3COO―)>c(OH―)=c(H+)
6. 在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A. c(Na+)>c(Ac-)>c(H+)>c(OH-) B. c(Na+)>c(Ac-)>c(OH-)>c(H+)
C. c(Na+)=c(Ac-)+c(HAc) D. c(Na+)+c(H+)=c(Ac-)+c(OH-)
7等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,下列关系正确的是:
A. c(M+)>c(OH-)>c(A-)>c(H+) B. c(M+)>c(A-)>c(H+)>c(OH-)
C.
c(M+)>c(A-)>c(OH-)>c(H+) D. c(M+)>c(H+) >c(OH-)
>c(A-)
(2)c(H+)=c(OH―)的强酸(弱酸)与弱碱(强碱)等体积混合
8.常温下,将pH=2的盐酸与pH=12的氨水等体积混合后,离子浓度的关系正确的是( )
A.c(Cl―)>c(NH4+)>c(H+)>c(OH―) B.c(NH4+)>c(Cl―)> c(H+)>c(OH―)
C.c(Cl―)=c(NH4+)>c(H+)=c(OH―) D.c(NH4+)>c(Cl―)> c(OH―)> c(H+)
(3)强酸(弱酸)与弱碱(强碱)非等物质的量混合
9. 0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后,混合溶液呈碱性,则下列关系正确的是( )
A.c(HCN)<c(CN―) B.c(Na+)>c(CN―)
C.c(HCN) -c(CN―)=c(OH―) D.c(HCN)+ c(CN―)=0.2mol/L
10.把 0.02mol/L HAc 溶液和 0.01mol/L NaOH 溶液以等体积混合,混合后溶液显酸性,则混合液中微粒浓度关系正确的是(99上海)
A c(Ac-)<c(Na+) B c(HAc)>c(Ac-)
C 2c(H+)=c(Ac-)-c(HAc) D c(HAc)+c(Ac-)=0.01 mol/L
(4)已知酸碱混合液的pH
11.常温下,将HCN与NaOH溶液混合,所得溶液pH=7,此溶液中( )
A.c(CN―)>c(Na+) B. c(CN―)<c(Na+)
C.c(CN―)=c(Na+) D.无法确定
12.常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是
A.当pH>7时,c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.当pH=7时,c(NH4+)>c(Cl-)>c(H+)=c(OH-)
C.当pH<7时,c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.当氨水与盐酸恰好完全反应时,c(Cl-)>c(NH4+)>c(H+)>c(OH-)
13.常温将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列正确的是
A.若混合溶液的pH=7,则c1V1=c2V2
B.若V1=V2,c1=c2,则溶液中c(NH4+)== c(Cl-)
C.若混合溶液的pH=7,则溶液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1== c2
2、酸(或碱)与盐的混合液
(1)强酸(强碱)与强碱弱酸盐(强酸弱碱盐)等物质的量混合
14. 0.1mol•L-1NaOH溶液和0.1mol••L-1 NH4Cl溶液等体积混合后,离子浓度的正确的是
A. c(Cl―)>c(Na+)> c(OH―)>c(H+) B.c(Na+)>c(Cl―)>c(OH―)>c(H+)
C.c(Na+)=c(Cl―)> c(OH―)>c(H+) D.c(Na+)=c(Cl―)> c(H+)>c(OH―)
15.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是
A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) B.c(Ac-)=c(Cl-)>c(HAc)>c(H+)
C.c(Ac-)=c(Cl+)>c(H+)>c(HAc) D.c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-)
(2)弱酸(弱碱)与强碱弱酸盐(强酸弱碱盐)等物质的量混合
16..用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO―)>c(Na+),对该混合溶液的下列判断正确的是( )
A.c(H+)>c(OH―) B.c(CH3COOH)+c(CH3COO―)=0.2 mol/L
C.c(CH3COOH)>c(CH3COO―) D.c(CH3COO―)+c(OH―)=0.2 mol/L
3、正盐和酸式盐的混合
17.用300mL1mol/LNaOH溶液吸收0.2molCO2,所得溶液中CO32―和HCO3-的物质的量浓度之比是
A.c(Na+)>c(CO32―)>c(HCO3―)>c(OH―)>c(H+)
B.c(Na+)>c(HCO3―)>c(CO32―)>c(OH―)>c(H+)
C.c(Na+)>c(OH―)c(HCO3―)>c(CO32―)>c(H+)
D.c(Na+)>c(HCO3―)>c(CO32―)>c(H+)>c(OH―)
18.将标准状况下2.24L CO2通入150 mL 1mol/LNaOH溶液中,下列正确的是 (04上海)
A. c( HCO3-)略大于c( CO32-) B. 能使酸性高锰酸钾溶液褪色
C. c(Na+)等于c( CO32-)与c( HCO3-)之和 D. c( HCO3-)略小于c( CO32-)
综合题
19(04天津)下列混合溶液中,各离子浓度的大小顺序正确的是
A.10ml0.1mol/L氨水与10ml0.1mol/L盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10ml0.1mol/LNH4Cl与5ml0.2mol/LNaOH混合,c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10ml0.1mol/L乙酸与5ml0.2mol/LNaOH混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10ml0.5mol/LCH3COONa与6ml1mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+)