高三化学冲刺考试试卷
可能用到的相对原子质量: H:1 N:14 O:16 C:12 Cl:35.5 Na:23 Mg:24 Al:27 Ca:40 K:39 S:32 Ba:137 Br:80
第I卷(选择题 共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.自然环境与人们的生活息息相关。下列有关环境的说法不正确的是
A.氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.废旧电池的回收,其主要目的是为了保护环境,而不是回收金属
D.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
2.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列对有关实验事实的解释正确的是
A.溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
B.用惰性电极电解相同浓度的Cu(NO3)2和AgNO3混合溶液,阴极首先析出的是Ag,说明Ag+ 的还原性比Cu2+ 强
C.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
D.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
3.下列反应:①Na + H2O,②NaH + H2O,③NO2 + H2O,④Cl2 + H2O,⑤IBr + H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是
A.①③ B.②⑤ C.③④ D.④⑤
4.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C—H键的离解能:
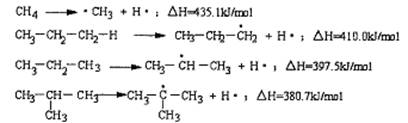
根据提供数据判断下列说法不正确的是
A、离解能愈小,C—H键易断裂,氢原子越易被取代
B、在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C、异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D、C2H6中C—H的离解能介于410.0 kJ /mol~435.1kJ/mol
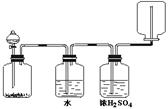 5.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
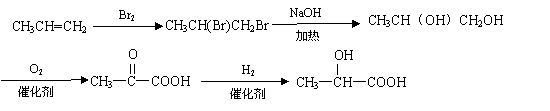
5.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A.浓硫酸和乙醇反应制备乙烯
B.浓盐酸和二氧化锰反应制备氯气
C.碳酸钙和盐酸反应制备二氧化碳
D.锌和盐酸反应制备氢气
6.已知反应:AgI+2CN—=[Ag(CN)2]—+I—,把KNO3、Al(OH)3、BaCO3和AgI的混合物按加入试剂的先后顺序,将其逐一溶解,最适宜的一组试剂是
A.H2O、稀盐酸、NaOH溶液、KCN溶液
B.H2O、稀硫酸、氨水、KCN溶液
C.H2O、KCN溶液、NaOH溶液、氨水
D.H2O、NaOH溶液、稀盐酸、KCN溶液
7.阿伏加德罗常数约为6.02×1023 mol—1,下列说法正确的是
A.2.7g铝与足量的氢氧化钠溶液反应转移的电子数约是0.6×6.02×1023
B.标准状况下,22.4升Cl2和H2的混合气经光照反应后,原子总数约为6.02×1023
C.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3×6.02×1023
D.25℃时,1L pH=13的氢氧化钠溶液中含有的氢氧根离子数约为6.02×1023
8.下列实验过程中产生的现象与对应的图形符合的是
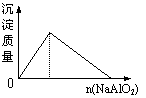 | |||
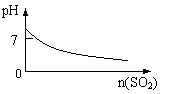 | |||
A.盐酸中加入NaAlO2溶液 B.SO2气体通入溴水中
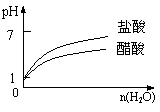
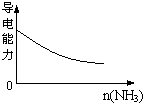
C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH = CO2↑+ H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 苯酚钠溶液中通入 少量CO2 | C6H5O—+ CO2 + H2O → C6H5OH + HCO3— | 错误,通入少量CO2应生成CO32— |
| C | NaHCO3的水解 | HCO3-+H2O | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2+ + 2Br—+ 2Cl2 = 2Fe3+ + Br2 + 4Cl— | 正确 |
10.下列各组离子,在所给条件下一定能够大量共存的是
A.pH=0的溶液中:Fe3+、Mg2+、NO3-、SO42-
B.能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
C.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2—、SO32—
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl-
11.将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到Ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到Bg沉淀,则下列说法正确的是
A.标准状况下,参加反应的CO2体积为0.224AL
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物只有Na2CO3
D.B可能等于A、小于A或大于A
![]() 12.如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
12.如图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
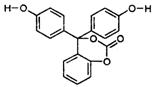 ,关于该化合物的下列说法中,正确的是
,关于该化合物的下列说法中,正确的是
A.该有机物的化学式为C20H14O5
B.1mol该有机物与浓溴水反应,消耗5molBr2
C.与足量氢氧化钠溶液充分反应,所得产物中相对分子质量较小的钠盐为HCOONa
D.1mol该有机物在铜铬氧化物催化下能与2mol氢气发生反应
13.甲、乙、丙、丁为短周期元素形成的粒子,它们的电子总数相等。已知四种粒子中,甲、乙为分子,丙为双原子构成的负二价阴离子,丁为原子。则下列说法正确的是
A.丙与钙离子组成的化合物为离子化合物
B.丁原子一定是稀有气体原子
C.甲、乙的分子中可能有非极性分子
D.丙与钙离子组成的化合物和水反应生成的气体一定是乙炔
![]()
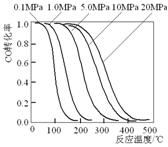
![]() 14.甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右图;目前正在开发的新法是:
14.甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右图;目前正在开发的新法是:
 2CH4+ O2
2CH3OH 。下列关于新法和旧法的说法正确的是
2CH4+ O2
2CH3OH 。下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法合成比低压法合成更
有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是提高空气中氧气的转化率
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.在0.1mol·L-1Na2CO3溶液中:c(OH—)==c(HCO3—)+c(H+)+ c(H2CO3)
C.pH>7的NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-) >c(OH—) >c(H+)
D.pH>7的CH3COONa与NaOH的混合溶液中一定有:c(Na+)>c(CH3COO—) >c(OH—) >c(H+)
 16.如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度下,关闭活塞K,使两容器中各自反应:
16.如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度下,关闭活塞K,使两容器中各自反应:
X (g)+ Y(g) ![]() Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
A.反应速率:v(B)![]() >v(A)
>v(A)
B.A容器中X的转化率为 20%
C.平衡时的压强:PB=2PA
D.若打开K,则达到新的化学平衡时,A的体积为2.6a L
三、(本题包括2小题,共22分)
17.(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)不用普通滤纸过滤器过滤KMnO4溶液的原因是_______________________________;
(2)如何保证在700C-800C条件下进行滴定操作:______________________________;
(3)准确量取一定体积的KMnO4溶液用________________;
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用___________(填序号);
A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将_____(填“偏高”或“偏低”)
18.(12分)某同学对课本实验结论:“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了研究。
(一)提出猜想: 。
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;
③在空气中灼烧Cu2O能生成CuO。
(三)制备红色沉淀:①制备氢氧化铜悬浊液 ②氢氧化铜悬浊液与葡萄糖共热 ③过滤、洗涤、低温烘干得红色粉末。
(四)红色沉淀探究 该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:称得干燥坩埚a g ,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系。
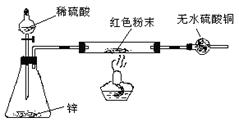 方案Ⅳ:装置如右图所示:(夹持仪器略去)试回答下列问题:
方案Ⅳ:装置如右图所示:(夹持仪器略去)试回答下列问题:
(1) 请你评价方案Ⅰ和方案Ⅱ。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
评价方案Ⅰ
评价方案Ⅱ
(2)方案Ⅲ中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
(3)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量 (填序号)。
①通入氢气体积 ② 反应前,红色粉末+反应管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+反应管的总质量 ⑤反应管的质量 ⑥ 锌粒质量 ⑦ 稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(4)有人提出:方案Ⅳ中,在氢气发生器与反应管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由 。
四、(本题包括2小题,共18分)
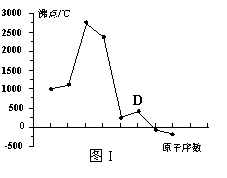 19.(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
19.(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
| 化合物 | 甲 | 乙 | 丙 |
| 原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶2 |
(1)元素D在元素周期中的位置 。
(2)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
(3)写出图I中沸点最高的单质与NaOH溶液反应的离子方程式 。
20.(10分)已知A—L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②—③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:
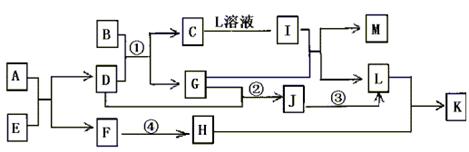
(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,
写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
五、(本题包括1小题,共10分)
21.(10分)2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 。
![]() A.制备环氧乙烷:
A.制备环氧乙烷:
![]() B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN—有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN—氧化为CO32—和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO—也能将CN—氧化,但实际处理时却不在酸性条件下进行的主要原因是 。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 |
|
| 乙烯 | 来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
六、(本题包括2小题,共18分)
22.(8分)现有A、B两种有机化合物,已知:①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;③它们都是一取代苯,分子中都没有甲基,都有一个羧基。请按要求填空:
⑴A、B的分子中氢元素的质量分数都是_________________;
⑵A的结构简式是___________________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是_____________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有两种,D的结构简式是____________________________________________。
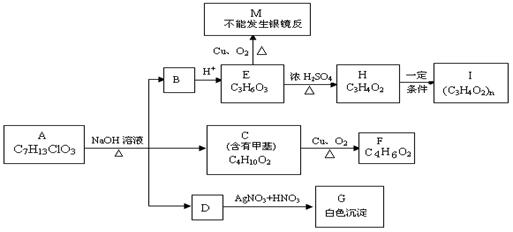 23.(10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
23.(10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
(1)A的结构简式: ;
(2)写出反应类型: E→H 、H→I ;
(3)写出C→F的化学方程式: 。
(4)请设计出由丙烯合成CH3—CH(OH)—COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
![]()
![]()
![]() B
C
……
G
B
C
……
G
七、(本题包括2小题,共18分)
24.(8分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
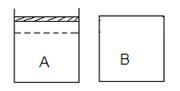
![]() 25.(10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
25.(10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。 试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 。
参考答案:
1-8:A、C、C、B、D、D、C、C; 9-16:D、A、AC、A、AC、AC、C、AD
17.(1)高锰酸钾强氧化性能氧化滤纸发生反应,高锰酸钾被消耗(2分)(2)水浴加热,用温度计控制水温(2分)(3)酸式滴定管;(2分)(4)A;(2分)(5)偏高(2分)
18.(共12分)(一)红色沉淀可能是铜、氧化亚铜或两者的混合物。(2分)
(四)(1)方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;(2分)
方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质。(2分)
(2) c=(10b-a)/9(2分)
(3)②④⑤(全对给2分,少选、错选均不得分)
(4)需要(1分)反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿。(1分)
19.(8分,每空2分)⑴第三周期第VIA族;⑵C3N4、大于;⑶2Al+2OH-+2H2O=2AlO2-+3H2↑
20.(10分)
|
(2)催化剂、400-500℃,沸腾炉
![]() (3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(2分)
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(2分)
Na2CO3+SiO2 Na2SiO3+CO2↑(2分)
21.(10分,每空2分)
(1)BD
(2)5ClO—+2CN—+2OH—=2CO32—+N2↑+5Cl—+H2O,在酸性条件下,CN—与H+结合生成毒性很强的HCN,对人和环境造成危害。
(3)虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得。
22.(每空2分,共8分) ⑴ 6.67%
⑵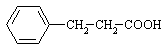 ⑶
⑶![]() ⑷
⑷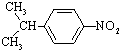
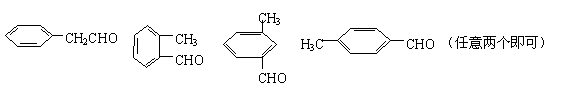 23.(10分)
23.(10分)
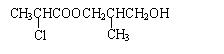
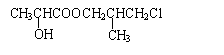 (1)(2分,每个结构简式1分)
(1)(2分,每个结构简式1分)
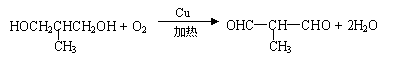 (2)(2分,每空1分)消去、加聚
(2)(2分,每空1分)消去、加聚
(3)(2分)
 (4)(4分)
(4)(4分)
24.(8分,(1)、(2)各2分,(3)4分)
(1)2、5、6、2、10、8
(2)酸式、当看到滴入1滴KMnO4溶液,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点。
(3)34.60%
25.(10分)(1)25% (2分) 增加N2、H2或降低温度 (2分) (2) 0.5 (2分)
(3) 0.8<c≦2 (2分) (4) 5.5 (2分)