高三化学化工试题专辑
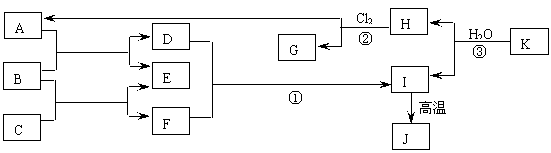
一、下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
 |
请按要求回答:
(1)写出B的化学式 ,G的电子式 ;
(2)反应①的离子方程式 ;
(3)反应②进行的条件是 , ;
(4)反应③的化学方程式为 。
二、X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
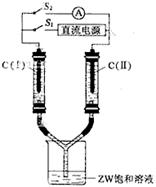 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
三、(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
反应中_________元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为
强弱为:Cl-<Br-<CN-<SCN-<I-,试写出:
①(CN)2与KOH溶液反应的化学方程式
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式
四、铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。
(1)配平制取铁酸钠的化学方程式:Fe(NO3)+NaOH+Cl2─Na2FeO4+NaNO3+NaCl+H2O
反应中 元素被氧化,转移电子总数为
(2)铁酸钠之所以能净水,除了能消毒外,另一个原因是
五、下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
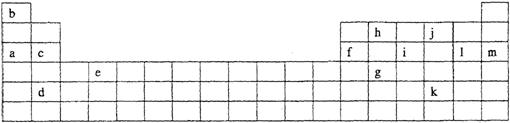
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
六、a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属
(5)c微粒是 ,f微粒是 (用化学式表示)
七、在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
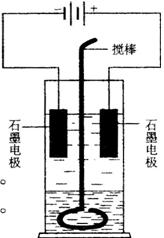 (1)阳极上的电极反应式为________________________________。
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为________________________________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________
_____________________________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是__________________
_____________________________________________________________________________________________________________________________,现象是_________________________________________________________________________________。
八、A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
九、根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
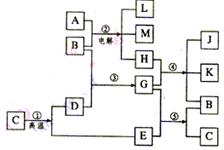 (1)单质L是 。
(1)单质L是 。
(2)化合物B是 。
(3)图中除反应①以外,还有两个用于工业生产的反应,
是 和 (填代号)。它们的化学反应方程式
分别是 ______________________________________
和 _____________________________________ 。
十、X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:![]() (气),
(气),![]() (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是_______________________________
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是____________
________________________________________。
十一、某无色溶液可能含有下列钠盐中的几种:(A)氯化钠 (B)硫化钠 (C)亚硫酸钠 (D)硫代硫酸钠 (E)硫酸钠 (F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色,说明该气体中不含____________(填分子式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。
第一种情况是____________,第二种情况是____________;
第三种情况是____________,第四种情况是____________。(可不填满,也可补充)
十二、下图表示制备无水盐E的主要步骤:
已知B是石灰石,D盐含有约49%的结晶水,无水盐E可
作干燥剂。取少量E溶于水,向其中滴加硝酸后,再滴
加硝酸银溶液,有白色沉淀F生成。填写以下空白:
A____________,C_____________,D______________,
E_____________,F______________。
十三、下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
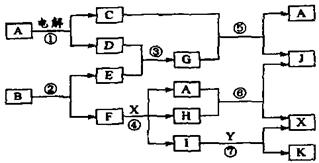
请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
(2)反应⑤的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。
十四、下图表示某种盐的制备步骤:
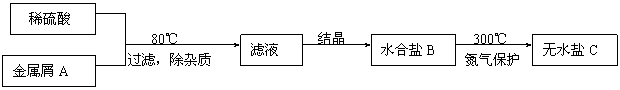
已知:水合盐B含有45.3%的水;无水盐C焙烧分解,放出两种无色刺激性气体E和F,并生成红棕色固体D。
请写出物质的化学式或名称:
A ,B ,C ,D ,
E ,F 。
十五、利用卤块(主要成分为MgCl2含Fe2+、Fe3+杂质)按下工程流程图,即可制得“轻质MgO”
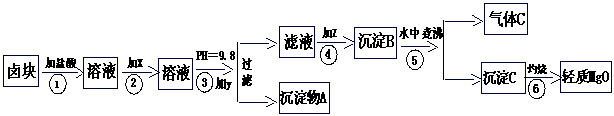
回答下列问题:
(1)在步骤②加入的试剂x,最佳选择是
A. 漂液 (含NaClO 25.2%) 450元/t B. H2O2(30%) 2400元/t
C. NaOH (98%) 2100元/t D. Na2CO3 (99.5%) 600元/t
(2)写出下列化学式:B是 ,气体C是
(3)写出沉淀A的离子方程式
(4)如何检验所得的轻质氧化镁为纯净?
(5)步骤⑤水中煮沸的目的是
十六、下表中的数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚Y/nm | 0.05a | 0.20a | 0.45a | 0.80a | 1.25a * |
| NiO层厚Y'/nm | 1b | 2b | 3b | 4b | 5b* |
*a和b均为与温度有关的常数。
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是(填“直线”、“抛物线”、“对数线”或“双曲线”等类型):MgO氧化膜的膜厚Y属于 型,NiO氧化膜的膜厚Y'属于 型。
(3)Mg与Ni比较,哪一种金属具有更良好的耐氧化腐蚀性: ,其理由是
十七、合成相对分子质量在2000-50000范围内,具有确定结构的有机化合物是一个新的研究领
域。1993年报道合成了两种烃A和B,其分子式分别为C1134H1146和C1398H1278。
A分子中只具有a、b、c三种结构单元,B分子则具有a、b、c、d四种结构单元。
已知A、B分子中都没有苯环—苯环或脂基—脂基的结构。试求A、B分子中上述结构单元有几个。
十八、在长期载人太空飞行宇宙器中,每个宇航员平均每天需要消耗0.9kg氧气,呼出1.0kg二氧化碳。为了能保持飞船坐舱内空气的稳定,宇航科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断把坐舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入坐舱。有关反应的化学方程式是(1)__________________
____________________________________________(2)________________________________________;将处理后的气体充入坐舱时,应注意采取的一项措施是________________________________________。
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下图:
(1)管道①把飞船坐舱中含有较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的N极室,通过该电极反应可使二氧化碳不断被吸收:该电极反应式为____________________________________,其电解产物吸收二氧化碳的离子方程式为_______________________________________,在N极吸收二氧化碳后形成的离子会通过隔膜进入M极室,通过M极的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的PH不变;该电极反应式为________________________________________,二氧化碳逸出的离子方程式为_______________________________________________________________________。
(2)管道②是将处理后的空气混入“电解水系统”产生新鲜氧气,然后通入飞船坐舱内供宇航员呼吸用。在“电解水系统”中,Y为___________极(填“阴”或“阳”),X的电极反应式____________________________
__________________________________。
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体,请评价这样处理的重要意义________________
_______________________________________________________________________________________________________________________________________________________________________________。
十九、近年,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断(这一判断的正确性有待证明):当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
二十、根据下列反应框图回答下列问题:
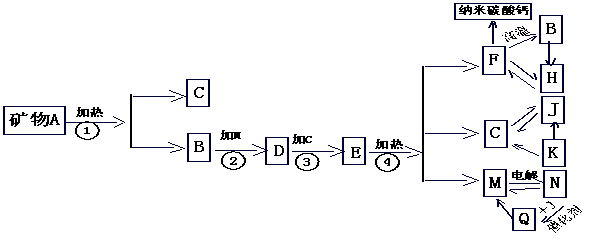
(1)请你估计选用的矿物A是 , 合理解析是
(2)写出下列物质的化学式:M ,Q 。
(3)写出步骤③的化学方程式
(4)写出M→N的电解反应方程式
二十一、使用Mg粉、盐酸、醋酸和下图装置,在同温同压下进行实验。
(1)盐酸、醋酸的物质的量浓度都是0.5mol/L,所用的体积都是20mL,镁粉过量。反应开始时,哪种溶液中反应的速率较快?
一段时间以后,观察到的现象是 反应至不再有气体逸出后,收集到的气体的体积是否相同? (填“相同”“不相同”“无法确定”)
(2)写出有关的离子方程式
(3)通过上述实验所得的结论是
(4)本实验所用玻璃仪器 都应该一样。对试剂的要求除酸的浓度应相同,体积相同、镁粉过量,还应注意
。